题目内容
在一定温度下,在10L密闭容器中加入5molSO2和一定量的氧气,在一定条件下发生反应: 2SO2(g)+O2(g) 2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
(1)氧气的起始浓度为 。
(2)平衡时剩余SO2 mol;
(3)该条件下SO2的最大转化率为 ;
(4)平衡时体系中SO3的百分含量(体积分数)为 ;
(5)平衡体系中SO2、O2和SO3的物质的量之比为 。
 2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。(1)氧气的起始浓度为 。
(2)平衡时剩余SO2 mol;
(3)该条件下SO2的最大转化率为 ;
(4)平衡时体系中SO3的百分含量(体积分数)为 ;
(5)平衡体系中SO2、O2和SO3的物质的量之比为 。
(5分)(1)0.5mol/L;(2)1; (3)80%;(4)50%;(5)1:3:4
试题分析: 2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)起始浓度(mol/L) 0.5 x 0
转化浓度(mol/L) 0.4 0.2 0.4
平衡浓度(mol/L) 0.1 0.3 0.4
所以氧气的起始浓度为0.2mol/L+0.3mol/L=0.5mol/L
平衡时剩余SO2的物质的量是0.1mol/L×10L=1mol
该条件下SO2的最大转化率为

平衡时体系中SO3的百分含量(体积分数)为

平衡体系中SO2、O2和SO3的物质的量之比为0.1:0.3:0.4=1:3:4
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
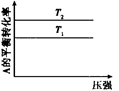

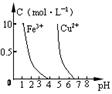
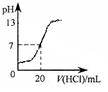
 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1 2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( ) 2C(g) △H=-QkJ·mol-1 (Q>0)在一个密闭容
2C(g) △H=-QkJ·mol-1 (Q>0)在一个密闭容 H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡( )
H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡( ) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( ) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为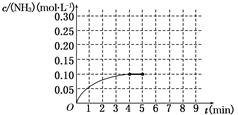
 pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是