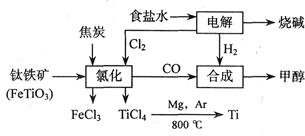
��Ŀ����
��(Ti)����Ϊ��������֮��ĵ���������Ҳ����˵21�������ѵ����͡����ڵؿ��еĺ��������٣����ѵ�ұ��������δ���ͻ�ƣ�Ŀǰ��ֻ���ڼ������
����ͼ��ʾ�����ѳ����ȼ�ͼ״�����ɲ�ҵ���ɴ�������Դ�����ʣ����ٻ�����Ⱦ��
����д���пհף�
��1���ö��Ե缫���2 Lʳ��ˮʱ���ܷ�Ӧ�����ӷ���ʽ_______________________________���������ϲ���224 mL���壨��״����ʱ��������Һ��pH= ��������ǰ����Һ�������,ʳ��ˮ��������
��2��д���������������Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ ������ʾ��FeTiO3��TiΪ+4�ۣ�
��3����Ӧ2Mg��TiCl4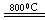 2MgCl4��Ti��Ar�����н��е�������____________________��
2MgCl4��Ti��Ar������������____________________��
��4����������һ����Ҫ�����ȼ�ϣ�����ͨ���״����Ӽ���ˮ�Ƶã�
2CH3OH(g)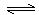 CH3OCH3(g)+H2O(g)����H=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g)����H=" -23.5" kJ/mol
T1 ��ʱ���ں����ܱ������н�������ƽ�⣬��ϵ�и����Ũ����ʱ��仯����ͼ��ʾ��
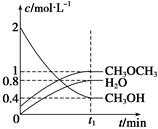
��T1 ��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ������������
����ͬ�����£����ı���ʼŨ�ȣ�ijʱ�̸����Ũ������Ϊc(CH3OH)="0.4" mol/L��c(H2O)="0.6" mol/L��(CH3OCH3)="1.2" mol/L����ʱ�����淴Ӧ���ʵĴ�С��v��������v��(�>������<����=��)��
��5����������ҵ���У��ϳ�192�ּ״�����������ⲹ��H2__________�� ���������������������ʵ��κ���ʧ����
����ͼ��ʾ�����ѳ����ȼ�ͼ״�����ɲ�ҵ���ɴ�������Դ�����ʣ����ٻ�����Ⱦ��

����д���пհף�
��1���ö��Ե缫���2 Lʳ��ˮʱ���ܷ�Ӧ�����ӷ���ʽ_______________________________���������ϲ���224 mL���壨��״����ʱ��������Һ��pH= ��������ǰ����Һ�������,ʳ��ˮ��������
��2��д���������������Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ ������ʾ��FeTiO3��TiΪ+4�ۣ�
��3����Ӧ2Mg��TiCl4
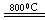 2MgCl4��Ti��Ar������������____________________��
2MgCl4��Ti��Ar�����н��е�������____________________����4����������һ����Ҫ�����ȼ�ϣ�����ͨ���״����Ӽ���ˮ�Ƶã�
2CH3OH(g)
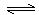 CH3OCH3(g)+H2O(g)����H=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g)����H=" -23.5" kJ/molT1 ��ʱ���ں����ܱ������н�������ƽ�⣬��ϵ�и����Ũ����ʱ��仯����ͼ��ʾ��

��T1 ��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ������������
����ͬ�����£����ı���ʼŨ�ȣ�ijʱ�̸����Ũ������Ϊc(CH3OH)="0.4" mol/L��c(H2O)="0.6" mol/L��(CH3OCH3)="1.2" mol/L����ʱ�����淴Ӧ���ʵĴ�С��v��������v��(�>������<����=��)��
��5����������ҵ���У��ϳ�192�ּ״�����������ⲹ��H2__________�� ���������������������ʵ��κ���ʧ����
��14�֣�ÿ��2��) ��1��2Cl����2H2O 2OH����H2����Cl2����12
2OH����H2����Cl2����12
��2��2FeTiO3��6C��7Cl2 2TiCl4��2FeCl3��6CO��
2TiCl4��2FeCl3��6CO��
��3����ֹ������Mg��Ti������е�O2����CO2��N2����Ӧ�� ��4�� ��5 �ڣ� ��5��10
 2OH����H2����Cl2����12
2OH����H2����Cl2����12 ��2��2FeTiO3��6C��7Cl2
 2TiCl4��2FeCl3��6CO��
2TiCl4��2FeCl3��6CO����3����ֹ������Mg��Ti������е�O2����CO2��N2����Ӧ�� ��4�� ��5 �ڣ� ��5��10
�����������1���ö��Ե缫���ʳ��ˮʱ���ܷ�Ӧ�����ӷ���ʽ��2Cl����2H2O
 2OH����H2����Cl2���������������ӷŵ磬�������������������ʵ�����0.224L��22.4L/mol��0.01mol������ݷ���ʽ��֪�����ɵ�����������0.02mol����������������Һ��Ũ����0.02mol��2L��0.01mol/L����pH��12��
2OH����H2����Cl2���������������ӷŵ磬�������������������ʵ�����0.224L��22.4L/mol��0.01mol������ݷ���ʽ��֪�����ɵ�����������0.02mol����������������Һ��Ũ����0.02mol��2L��0.01mol/L����pH��12����2��������̼������������CO�������������Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ��2FeTiO3��6C��7Cl2
 2TiCl4��2FeCl3��6CO��
2TiCl4��2FeCl3��6CO����3���ڸ�����þ���Ѿ��ܺͿ����е�����������CO2��Ӧ�����Է�Ӧ��Ar�����н��е������Ƿ�ֹ������Mg��Ti������е�O2����CO2��N2����Ӧ��
��4���ٻ�ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը���ͼ���֪ƽ��ʱ���ѡ�ˮ�����ͼ״���Ũ�ȷֱ��ǣ�mol/L��1��0.8��0.4����÷�Ӧ��ƽ�ⳣ��K��
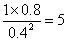 ��
����ijʱ�̸����Ũ������Ϊc(CH3OH)="0.4" mol/L��c(H2O)="0.6" mol/L��(CH3OCH3)="1.2" mol/L����ʱ
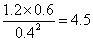 ��5����������Ӧ���ʴ����淴Ӧ���ʡ�
��5����������Ӧ���ʴ����淴Ӧ���ʡ���5�������ɷ���ʽCO��g��+2H2��g��
 CH3OH��g����2FeTiO3+6C+7Cl2��2FeCl3+2TiCl4+6CO��2NaCl+2H2O��2NaOH+H2��+Cl2���ɵ����¹�ϵʽ��6CH3OH��6CO��7Cl2��7H2����6CH3OH��12H2����ÿ����6molCH3OH��192g������ⲹ��5molH2��10g����������192t�״�����������ⲹ��10t������
CH3OH��g����2FeTiO3+6C+7Cl2��2FeCl3+2TiCl4+6CO��2NaCl+2H2O��2NaOH+H2��+Cl2���ɵ����¹�ϵʽ��6CH3OH��6CO��7Cl2��7H2����6CH3OH��12H2����ÿ����6molCH3OH��192g������ⲹ��5molH2��10g����������192t�״�����������ⲹ��10t�����������������Ǹ߿��еij������ͣ��Ѷȴ��ۺ���ǿ����ѧ����Ҫ��ߡ�������ע�ضԻ���֪ʶ���̺�ѵ����ͬʱ�����ض�ѧ�������������ͽ��ⷽ����ָ����ѵ��������������ѧ�������������������ѧ��������û���֪ʶ���ʵ�����������������ѧ����ѧ����������������Ҫ��ѧ���ܹ��߱�ͨ������Ȼ�硢����������Ϳ�ѧʵ���л�ѧ�����Լ����ģ�͡�ͼ�κ�ͼ���ȵĹ۲죬��ȡ�йصĸ���֪ʶ��ӡ�����÷������Ƚϡ����������ɵȷ���������ȡ����Ϣ���г����ӹ���Ӧ�õ��������ܹ����ݡ�ȷ�ػ�ȡ���������������Ϣ����������֪ʶ���ϣ��ڷ������۵Ļ�����Ӧ������Ϣ��������

��ϰ��ϵ�д�
 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�
�����Ŀ
 pC(g) ?H=" Q" kJ��mol-1�����ܱ������н��У���ͼ��ʾ�ڲ�ͬʱ��t���¶�T��ѹǿP��������C�İٷֺ����Ĺ�ϵ���ߣ������ж���ȷ����
pC(g) ?H=" Q" kJ��mol-1�����ܱ������н��У���ͼ��ʾ�ڲ�ͬʱ��t���¶�T��ѹǿP��������C�İٷֺ����Ĺ�ϵ���ߣ������ж���ȷ����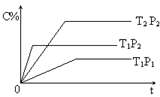
 bB(g)��ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%��������˵������ȷ����
bB(g)��ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%��������˵������ȷ����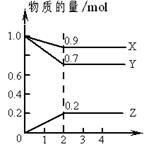
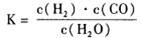
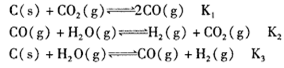
 �� �÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
�� �÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
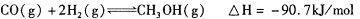
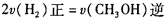
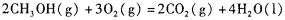 �����ĵ缫��ӦʽΪ_______��
�����ĵ缫��ӦʽΪ_______��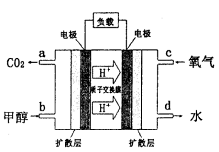
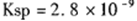 �� CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ�CaCl2��Һ��
�� CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ�CaCl2��Һ�� ��Na2CO3��Һ�������ϣ������ɳ���ʱԭCaCl2��Һ����СŨ��Ϊ_______��
��Na2CO3��Һ�������ϣ������ɳ���ʱԭCaCl2��Һ����СŨ��Ϊ_______��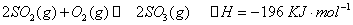 ʱ����2L�̶��ݻ����ܱ������г���2mol
ʱ����2L�̶��ݻ����ܱ������г���2mol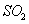 ��2mol
��2mol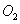 ��10���Ӻ�ﵽƽ�⣬
��10���Ӻ�ﵽƽ�⣬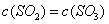
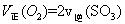 )
)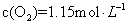 ������ͼ�ϻ���15-25����
������ͼ�ϻ���15-25���� ��Ũ�ȱ仯���ߡ�
��Ũ�ȱ仯���ߡ�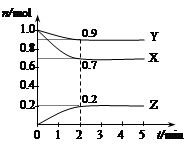
 2Z(g)
2Z(g) (X)��0.075 mol ��L-1�� min-1
(X)��0.075 mol ��L-1�� min-1 CO(g)��H2(g)��
CO(g)��H2(g)�� CO2(g)��H2(g)
CO2(g)��H2(g)