题目内容
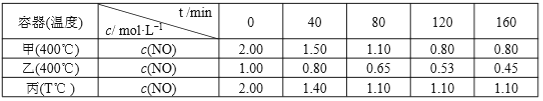
【题目】工业上利用氢气与氮气在高温、高压、催化剂作用下制取氨气:N2+3H2![]() 2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,H2不可能100%的转化为NH3
C.为了提高H2的转化率,应适当提高N2的浓度
D.达到平衡时,N2的浓度和H2的浓度之比为1:3
【答案】D
【解析】
A.催化剂能降低反应活化能,加快反应速率,提高生产效率,故A正确;
B.N2+3H2![]() 2NH3是可逆反应,在上述条件下,H2不可能100%的转化为NH3,故B正确;
2NH3是可逆反应,在上述条件下,H2不可能100%的转化为NH3,故B正确;
C.适当提高N2的浓度使平衡正向移动,提高H2的转化率,故C正确;
D.达到平衡时,N2的浓度和H2的浓度之比不一定为1:3,要看投料比,只有按N2的浓度和H2的浓度之比为1:3投料时,才有可能,故D错误;
故选D。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
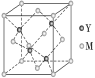
巧学巧练系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。
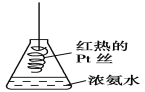
【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Ca(OH)2=CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为___________。
(2)制取氢氧化铜的化学方程式为______________________。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
(提出猜想)红色固体是:Ⅰ.Cu Ⅱ.Cu2O Ⅲ. ______________________。
(进行实验)
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 | 溶液由无色变蓝色,固体减少。 | 1.44g红色固体一定有:____________________ |
②过滤、洗涤、干燥。 | 得红色固体 |