题目内容
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为________,晶体中原子间通过________作用形成面心立方密堆积,其中M原子的配位数为________。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是________(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式)
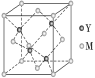
(3)M与Y形成的一种化合物的立方晶胞如图所示。该化合物的化学式为________,已知晶胞参数a=0.542 nm,此晶体的密度为__________g·cm-3。(列式,不要求结果,阿伏加德罗常数为NA)
【答案】金属晶体 金属键 12 1s22s22p63s23p5 Ar HClO4 CuCl ![]()
【解析】
据题给信息推断M为铜元素,Y为氯元素,据此解答。
(1)单质铜的晶体类型为金属晶体,晶体中微粒间通过金属键作用形成面心立方密堆积,铜原子的配位数为12,
故答案为:金属晶体;金属键;12;
(2)氯元素为17号元素,位于第三周期,根据构造原理知其基态原子的核外电子排布式为1s22s22p63s23p5 ,同周期元素由左向右元素原子的第一电离能呈增大趋势,故其同周期元素中,第一电离能最大的是Ar。氯元素的含氧酸中,酸性最强的是HClO4,
故答案为:1s22s22p63s23p5 ;Ar;HClO4;
(3)根据晶胞结构利用切割法分析,每个晶胞中含有铜原子个数为8×1/8+6×1/2=4,氯原子个数为4,该化合物的化学式为CuCl;则1mol晶胞中含有4mol CuCl,1mol晶胞的质量为4×99.5g,又晶胞参数a="0.542" nm,此晶体的密度为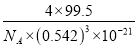 g·cm–3。
g·cm–3。
故答案为:CuCl;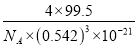 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
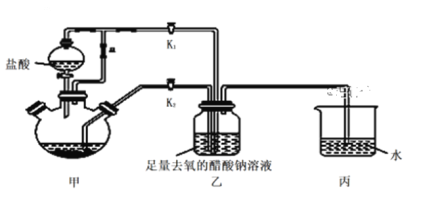
轻松课堂单元期中期末专题冲刺100分系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |