题目内容
【题目】25℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)上述三种弱酸中,酸性最强的是______________________________(填化学式),其电离方程式为_____________________________________________,电离平衡常数表达式K=_________。
(2)写出H2CO3溶液中存在的各种离子的符号:_________________________________。
(3)向Na2CO3溶液中加入足量HClO,有关反应的离子方程式为____________________________。
【答案】 HCOOH HCOOH![]() H++HCOO-
H++HCOO- 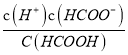 H+、HCO3-、CO32-、OH- CO32-+ HClO=HCO3- +ClO-
H+、HCO3-、CO32-、OH- CO32-+ HClO=HCO3- +ClO-
【解析】(1)上述三种弱酸中,HCOOH的电离常数最大,故酸性最强的是HCOOH,但是弱电解质,其电离方程式为HCOOH![]() H++HCOO-;电离平衡常数表达式K=
H++HCOO-;电离平衡常数表达式K=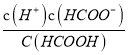 ;(2)H2CO3中存在以下反应:H2CO3
;(2)H2CO3中存在以下反应:H2CO3![]() H++HCO3-,HCO3-
H++HCO3-,HCO3-![]() H++CO32-,还有H2O
H++CO32-,还有H2O![]() H++OH-,H2CO3溶液中存在的各种离子的符号:H+、HCO3-、CO32-、OH- ;(3)电离平衡常数:K(H2CO3)>K(HClO)>K(HCO3-),向Na2CO3溶液中加入足量HClO,只生成HCO3-,有关反应的离子方程式为CO32-+ HClO=HCO3- +ClO-。
H++OH-,H2CO3溶液中存在的各种离子的符号:H+、HCO3-、CO32-、OH- ;(3)电离平衡常数:K(H2CO3)>K(HClO)>K(HCO3-),向Na2CO3溶液中加入足量HClO,只生成HCO3-,有关反应的离子方程式为CO32-+ HClO=HCO3- +ClO-。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目