题目内容
【题目】工业上合成氨的原理如下:N2(g)+3H2(g)![]() 2NH3(g) △H。
2NH3(g) △H。
(1)已知H-H键的键能为436 kJmol-1,N-H键的键能为391kJmol-1,N=N键的键能是945.6 kJmol-1,则上述反应的△H=________。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 molL-1 min-1;乙:v(N2)=2 molL-1 min-1; 丙:v(H2)=4.5molL-1 min-1;丁:v(NH3)=0.075 molL-1 min-1。若其他条件 相同,温度不同,则温度由高到低的顺序是______________(填序号)。
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为 2.8 mol,容器压强为8 MPa。则平衡常数Kp =________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(4)在773 K时,分別将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。

①图中表示c(N2)-t的曲线是________。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正________v逆(填“>”“<”或“=”)。
【答案】 -92. 4kJ mol-1 丁>乙>甲>丙 ![]() (或 0.26K) 乙 >
(或 0.26K) 乙 >
【解析】(1)反应热△H=反应物的总键能-生成物的总键能,故945.6 kJmol-1+3×436 kJmol-1-2×3×391kJmol-1= -92. 4kJ mol-1;(2)将速率全换成用N2表示:甲:v(N2)=v(NH3)/2=1.75molL-1 min-1;乙:v(N2)=2 molL-1 min-1; 丙:v(N2)=v(H2)/3=1.5molL-1 min-1;丁:v(N2)=v(NH3)/2=0.0375 molL-1 min-1。故反应速率顺序为:丁>乙>甲>丙;
(3)设参加反应的氮气物质的量为xmol,
该反应中N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol)1 3 0
变化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
列式可得:(1-x)+(3-3x)+2x=2.8,x=0.6;
平衡时各物质的压强之比等于其物质的量之比,所以P(N2)= ![]() ;P(H2)=
;P(H2)= ![]() ,P(NH3)=
,P(NH3)= ![]() ,化学平衡常数Kp=
,化学平衡常数Kp=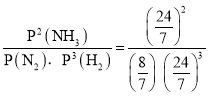 =0.26;
=0.26;
(4)①由反应方程式可知:N2(g)+3H2(g)![]() 2NH3(g)变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示c(N2)~t的曲线是乙;②由表可知表可知25min反应达平衡状态,
2NH3(g)变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示c(N2)~t的曲线是乙;②由表可知表可知25min反应达平衡状态,
N2(g)+3H2(g)![]() 2NH3(g),
2NH3(g),
初起(mol·L-1):2 6 0
变化(mol·L-1):1 3 2
平衡(mol·L-1):1 3 2
此时平衡常数为:K=![]() ,根据Qc=
,根据Qc=![]() <K,所以平衡正向移动,即此时v正大于v逆。
<K,所以平衡正向移动,即此时v正大于v逆。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】25℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)上述三种弱酸中,酸性最强的是______________________________(填化学式),其电离方程式为_____________________________________________,电离平衡常数表达式K=_________。
(2)写出H2CO3溶液中存在的各种离子的符号:_________________________________。
(3)向Na2CO3溶液中加入足量HClO,有关反应的离子方程式为____________________________。