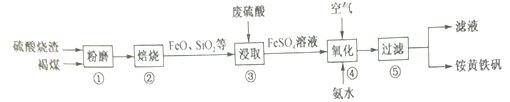
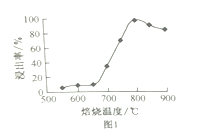
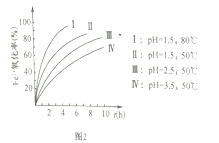
题目内容
【题目】A为含三种元素的钠盐,其水溶液显碱性.C为大理石的主要成分,请填空: 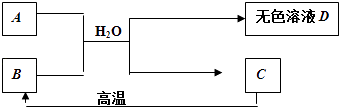
(1)C的化学式 .
(2)D中一定含有的溶质是 . 理由是(用化学方程式表示) .
(3)B用作食品干燥剂的原理: . (用化学方程式表示)
【答案】
(1)CaCO3
(2)氢氧化钠;Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
(3)CaO+H2O=Ca(OH)2
【解析】解:C为大理石的主要成分,则C为CaCO3 , A为含三种元素的钠盐,其水溶液显碱性,CaCO3高温分解得B,B与A在水中反应生成C,则B为CaO,A为Na2CO3 , 无色溶液D为氢氧化钠,氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙,符合各物质转化关系,(1)根据上面的分析可知,C的化学式为CaCO3 , 所以答案是:CaCO3; (2)根据上面的分析可知,D中一定含有的溶质是氢氧化钠,反应的化学方程为 Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,
所以答案是:氢氧化钠; Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;(3)B为CaO,B能吸收水生成氢氧化钙,所以可以用作食品干燥剂,涉及的化学方程式为CaO+H2O=Ca(OH)2 ,
所以答案是:CaO+H2O=Ca(OH)2 .

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】25℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)上述三种弱酸中,酸性最强的是______________________________(填化学式),其电离方程式为_____________________________________________,电离平衡常数表达式K=_________。
(2)写出H2CO3溶液中存在的各种离子的符号:_________________________________。
(3)向Na2CO3溶液中加入足量HClO,有关反应的离子方程式为____________________________。
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 常温下,加水稀释醋酸,![]() 增大
增大
C. 多元弱酸的酸性主要由第一步电离决定
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变