��Ŀ����
����Ŀ�������Ѱ۳����ᣨ��Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+���Ʊ����������[(NH4)2S2O8]��ͬʱ����TiO(OH)2�ļ�Ҫ�������£�
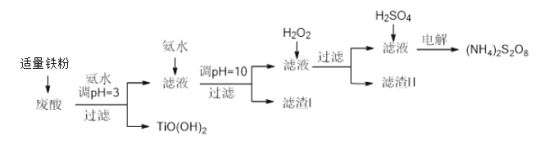
��֪��i.����������ȫ�����������������pH��
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������PH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+��
��ش��������⣺
��1��������������������________________________��
��2������TiO(OH)2�Ļ�ѧ����ʽ��____________________��
��3������I���������о����е����ʵĻ�ѧʽ��________
��4������H2O2��Ŀ������������Fe(II)��������[Fe(NH3)2]2+����ƽ�������ӷ���ʽ��2[Fe(NH3)2]2++____________+4H2O +H2O2=___________+ 4NH3��H2O��
��5�������£����Һ�к�������Ҫ������ʽ��pH�Ĺ�ϵ����ͼ��ʾ��
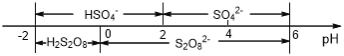
�������ŵ��������ҪΪHSO4-���������������Һ��pH��ΧΪ_________
��6����֪Ksp[Al(OH)3]=3.2��10-34 ����pH=10 ʱ������Һ��c(Al3+)=___________
��7��25�棬pH=3��(NH4)2SO4��Һ�У�����2c(SO42-)- c(NH4+) =___________����ʽ���ɣ�
���𰸡���Fe3+ ��ԭ��Fe2+������Fe3+ ��TiO2+ ͬʱ���� TiOSO4+2 NH3��H2O=(NH4)2SO4 +TiO(OH)2 �� Fe(OH)3 4OH- 2Fe(OH)3 0��PH��2 3.2��10-22 10-3-10-11
��������
�������̽�������Ϣ������Һ�����۷�Ӧ����Fe2+������pH=3ʹTiO2+����TiO(OH)2�������ڵ���pH=10��ʹFe2+������������������������������Ӵ��������������ɣ�pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+������������⣬����Ϊ���������������������ᣬ�������(NH4)2S2O8��
��1������Һ�к���Fe3+����������������Fe3+��Ӧ����Fe2+������Fe3+ ��TiO2+ ͬʱ������
��2��TiO2+�백ˮ��Ӧ����TiO(OH)2������笠����ӣ�����ʽΪTiOSO4+2 NH3��H2O =(NH4)2SO4 +TiO(OH)2 ����
��3������pHΪ10ʱ����Һ�е�Fe2+��Ϊ�����������������������������ֱ�����Ϊ����������������IΪ����������������������pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+�������������ʱ��+2��Fe��Ϊ+3��������������������������Ϊ����������������I���������о����е�����ΪFe(OH)3��
��4��H2O2��Fe(II)��������[Fe(NH3)2]2+��Ӧ������������������һˮ�ϰ�������ʽΪ2[Fe(NH3)2]2++4OH-+4H2O +H2O2= 2Fe(OH)3+ 4NH3��H2O��
��5���������̿�֪�����������IJ���Ϊ(NH4)2S2O8����HSO4-�ŵ磬���ͼ���֪��pH�ķ�ΧΪ0��pH��2��
��6����֪Ksp[Al(OH)3]=c(Al3+)��c3(OH-)=3.2��10-34 ��pH=10ʱ��c(OH-)=��10-4 mol/L�������ϵʽ����c(Al3+)=3.2��10-22 mol/L��
��7��������Һ�ʵ����ԣ�c(NH4+) +c(H+)=2c(SO42-)+c(OH-)����2c(SO42-)- c(NH4+) = c(H+)- c(OH-)=10-3-10-11 mol/L��

����Ŀ������![]() ʱijЩ���ʵ��ܽ��
ʱijЩ���ʵ��ܽ��![]() ���ݣ�
���ݣ�
|
|
|
|
|
|
|
|
����˵������ȷ���ǣ� ��
A.̼��þ����Һ�д���![]()
![]()
![]()
B.��![]() ��Һ���ݹ�¯�е�ˮ�����ɽ�ˮ���е�
��Һ���ݹ�¯�е�ˮ�����ɽ�ˮ���е�![]() ת��Ϊ
ת��Ϊ![]()
C.��![]() ����Һ�еμ�
����Һ�еμ�![]() ��������Ϊ���ɫ��˵���ܽ��
��������Ϊ���ɫ��˵���ܽ��![]()
D.��2mL����![]() ��Һ���Ⱥ�μ�
��Һ���Ⱥ�μ�![]() ��
��![]() ��NaOH��Һ��2�Σ������İ�ɫ����ֻ��
��NaOH��Һ��2�Σ������İ�ɫ����ֻ��![]()