题目内容
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③![]() ④
④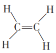 ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH⑧硬脂酸甘油酯⑨蛋白质⑩聚乙烯
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH⑧硬脂酸甘油酯⑨蛋白质⑩聚乙烯
A.能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B.含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
C.属于高分子材料的是⑧⑨⑩
D.投入钠能产生H2的是⑤⑦⑧⑨
【答案】B
【解析】
A.能跟溴的四氯化碳溶液发生加成反应的物质应含有碳碳双键或者碳碳三键,①苯和⑩聚乙烯中不含碳碳双键或者三键,不能与溴发生加成反应,故A错误;
B.苯是一种有毒的液体,分子式为C6H6,含碳量高,达92.3%,点燃时有浓烟,故B正确;
C.高分子材料属于高分子化合物,⑧硬脂酸甘油酯不是高分子化合物,不属于高分子材料,故C错误;
D.含有官能团:醇羟基、酚羟基、羧基的物质与钠反应能产生H2,⑧硬脂酸甘油酯官能团为酯基不能与钠反应,故D错误;
答案为B。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
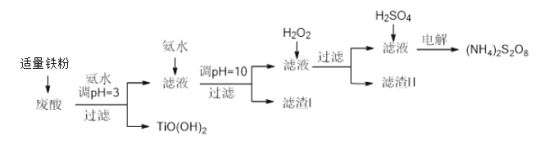
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是________________________。
(2)生成TiO(OH)2的化学方程式是____________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是________
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++____________+4H2O +H2O2=___________+ 4NH3·H2O。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
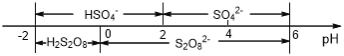
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为_________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=___________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =___________(列式即可)
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆


