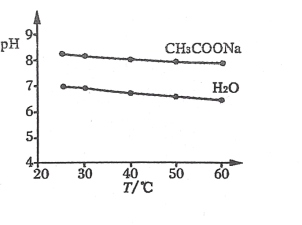
题目内容
【题目】根据![]() 时某些物质的溶解度
时某些物质的溶解度![]() 数据:
数据:
|
|
|
|
|
|
|
|
下列说法不正确的是( )
A.碳酸镁悬浊液中存在![]()
![]()
![]()
B.用![]() 溶液浸泡锅炉中的水垢,可将水垢中的
溶液浸泡锅炉中的水垢,可将水垢中的![]() 转化为
转化为![]()
C.向![]() 悬浊液中滴加
悬浊液中滴加![]() ,沉淀变为红褐色,说明溶解度
,沉淀变为红褐色,说明溶解度![]()
D.向2mL饱和![]() 溶液中先后滴加
溶液中先后滴加![]() 的
的![]() 、NaOH溶液各2滴,产生的白色沉淀只有
、NaOH溶液各2滴,产生的白色沉淀只有![]()
【答案】D
【解析】
A、碳酸镁悬浊液是碳酸镁的饱和溶液,存在溶解平衡,其溶解平衡的表达式为:![]() ,选项A正确;
,选项A正确;
B、根据Ksp可知,![]() 的溶解度大于
的溶解度大于![]() 的溶解度,而沉淀容易由溶解度大的向溶解度小的转化,故用
的溶解度,而沉淀容易由溶解度大的向溶解度小的转化,故用![]() 溶液浸泡锅炉中的水垢,可将水垢中的
溶液浸泡锅炉中的水垢,可将水垢中的![]() 转化为
转化为![]() ,选项B正确;
,选项B正确;
C、沉淀容易由溶解度大的向溶解度小的转化,向![]() 悬浊液中滴加
悬浊液中滴加![]() ,沉淀变为红褐色,即
,沉淀变为红褐色,即![]() 转化为
转化为![]() 沉淀,则说明溶解度
沉淀,则说明溶解度![]() ,选项C正确;
,选项C正确;
D、设产生![]() 沉淀时所需的碳酸根的浓度为
沉淀时所需的碳酸根的浓度为![]() ,产生
,产生![]() 沉淀是所需的氢氧根的浓度为
沉淀是所需的氢氧根的浓度为![]() ,根据
,根据![]() 的Ksp可知:
的Ksp可知:![]() ,根据
,根据![]() 的Ksp可知:
的Ksp可知:![]() ,即当同时产生
,即当同时产生![]() 和
和![]() 沉淀时,所需的碳酸根和氢氧根的浓度之比为:
沉淀时,所需的碳酸根和氢氧根的浓度之比为: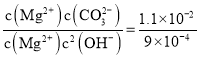 ,则
,则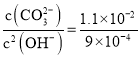 ,
, :3,故产生
:3,故产生![]() 沉淀所需的氢氧根的浓度比产生
沉淀所需的氢氧根的浓度比产生![]() 沉淀所需的碳酸根的浓度更高,故应先产生产生
沉淀所需的碳酸根的浓度更高,故应先产生产生![]() 沉淀,选项D错误。
沉淀,选项D错误。
答案选D。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
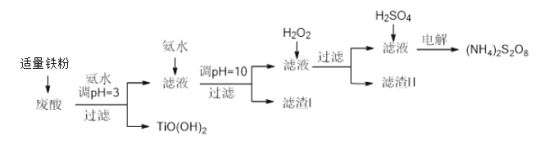
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是________________________。
(2)生成TiO(OH)2的化学方程式是____________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是________
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++____________+4H2O +H2O2=___________+ 4NH3·H2O。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
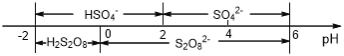
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为_________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=___________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =___________(列式即可)