题目内容
【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
I.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到 FeO( OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是 _____________。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
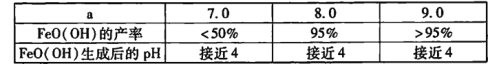
用离子方程式解释FeO( OH)生成后溶液pH下降的原因:____。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2 O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO( OH)向Fe2 O3的转化;
ii.溶液中存在少量Fe2+,导致FeO( OH)向Fe2O3的转化。
①经分析,假设i不成立的实验依据是____。
②其他条件相同时,向FeO( OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如下:
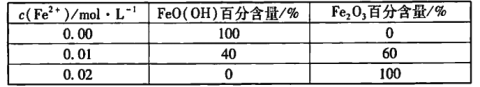
以上结果表明:____。
③ a=7和a =9时,FeO( OH)产率差异很大的原因是____。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO( OH)红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是____。
②已知N=n[FeO(OH)]/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是_________。
【答案】![]()
![]() a=8或9时反应后溶液的pH均接近4,即反应过程中溶液的酸性均增强 溶液中存在少量Fe2+可导致FeO( OH)向Fe2O3转化,且溶液中Fe2+含量越高相同时间内, FeO( OH)向Fe2O3转化的越多 a=9时,溶液中几乎没有Fe2+,而a=7时,溶液中还存在Fe2+ Fe2O3 在实验操作过程中,会有部分Fe2+被氧气氧化成Fe3+,故N=2时,参与共沉淀的Fe2+的量减少,导致生成的Fe3O4产率下降
a=8或9时反应后溶液的pH均接近4,即反应过程中溶液的酸性均增强 溶液中存在少量Fe2+可导致FeO( OH)向Fe2O3转化,且溶液中Fe2+含量越高相同时间内, FeO( OH)向Fe2O3转化的越多 a=9时,溶液中几乎没有Fe2+,而a=7时,溶液中还存在Fe2+ Fe2O3 在实验操作过程中,会有部分Fe2+被氧气氧化成Fe3+,故N=2时,参与共沉淀的Fe2+的量减少,导致生成的Fe3O4产率下降
【解析】
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀是亚铁离子结合氢氧根离子生成氢氧化亚铁沉淀,反应的离子方程式:![]() ,故答案为:
,故答案为:![]() 。
。
②FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO( OH)红棕色悬浊液,消耗氢氧根离子,溶液pH降低,反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() 。
。
(2)①根据表中数据,a=8或9时反应后溶液pH均接近于4即反应过程中溶液酸性均增强,说明假设i.反应过程中溶液酸性增强,导致FeO( OH)向Fe2O3的转化不正确。故答案为:a=8或9时反应后溶液的pH均接近4,即反应过程中溶液的酸性均增强。
②表中数据分析可知,其他条件相同时,向FeO( OH)浊液中加入不同浓度Fe2+,溶液中存在少量Fe2+可导致FeO( OH)向Fe2O3的转化,且溶液中亚铁离子含量越高,相同时间内FeO( OH)向Fe2O3的转化的越多。故答案为:溶液中存在少量Fe2+可导致FeO( OH)向Fe2O3转化,且溶液中Fe2+含量越高相同时间内, FeO( OH)向Fe2O3转化的越多
③a=7和a=9时,FeO( OH)产率差异很大的原因是:a=9时溶液中几乎无亚铁离子,而a=7时溶液中还存在亚铁离子。故答案为:a=9时,溶液中几乎没有Fe2+,而a=7时,溶液中还存在Fe2+。
(3)①共沉淀pH过低时,Fe2+导致FeO( OH)向Fe2O3的转化,则共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是:Fe2O3,故答案为:Fe2O3。
②经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是:实际操作过程中会有部分亚铁离子被氧气氧化为铁离子,故N=2时,参与共沉淀的亚铁离子减少,导致生成的Fe3O4的产率减小。故答案为:在实验操作过程中,会有部分Fe2+被氧气氧化成Fe3+,故N=2时,参与共沉淀的Fe2+的量减少,导致生成的Fe3O4产率下降。

 阅读快车系列答案
阅读快车系列答案