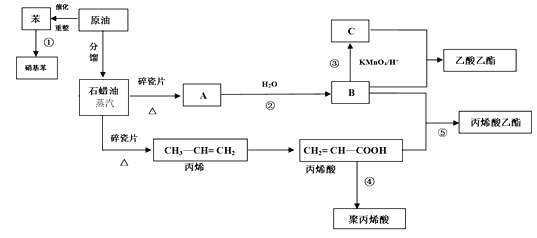
题目内容
【题目】某硝酸厂处理尾气中NO的方法是在催化剂存在下,用H2将NO还原为N2,其热化学方程式为NO(g)+H2(g)=![]() N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:
N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:

下列说法正确的是( )
A.过程①、②、③、④都是放热过程B.m=+![]() (a+b-c-d)kJ·mol-1
(a+b-c-d)kJ·mol-1
C.m=-![]() (c+a-d-b)kJ·mol-1D.m=+
(c+a-d-b)kJ·mol-1D.m=+![]() (c+d-a-b) kJ·mol-1
(c+d-a-b) kJ·mol-1
【答案】B
【解析】
键断裂吸热,键形成放热,则过程①、③是吸热过程,过程②、④是放热过程,故A错误;
根据能量变化图,则反应物断键共吸收(a+b)kJ能量,形成生成物中化学键共放出(d+c)kJ能量,所以该反应共放出(d+c-a-b)kJ的热量,热化学方程式为:2NO(g)+2H2(g)=N2(g)+2H2O(g)△H= -(d+c-a-b)kJmoL-1,所以NO(g)+H2(g)=![]() N2(g)+H2O(g) ΔH=+
N2(g)+H2O(g) ΔH=+![]() (a+b-c-d)kJ·mol-1,即m=+
(a+b-c-d)kJ·mol-1,即m=+![]() (a+b-c-d)kJ·mol-1,故B正确,C和D错误;
(a+b-c-d)kJ·mol-1,故B正确,C和D错误;
故答案为B。

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目