��Ŀ����
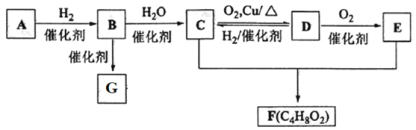
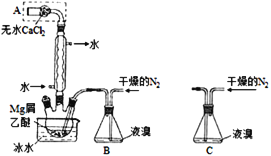
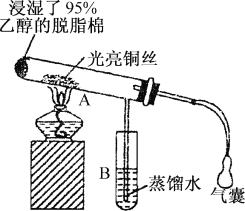
����Ŀ���йش����Ĵ�����������ɴ����Ҵ�������ʵ�����õ�һЩ��ʶ����ʵ��װ����ͼ��ʾ��ʵ�����Ϊ��Ԥ��ʹ���Ž��Ҵ���������ͼװ�úã���ͭ˿���м䲿�ּ��ȣ�Ƭ�̺�ʼ�н��ࣨ��Ъ�ԣ��ع�����������ɹ۲쵽���Ե�ʵ������
��ش��������⣺
��1�������ȵ�ͭ˿��������Ӧ�Ļ�ѧ����ʽΪ��________��
��2����A���пɹ۲쵽_______��ʵ�������п���ʶ���ڸ�ʵ������У������������ʱ�μ��˻�ѧ��Ӧ��������ʶ�������������ʱ��Ҫһ����_______��
��3����֪����������Ӧ�Ƿ��ȷ�Ӧ����ʵ�����һ��ʱ������ֻ�����ƾ��ƣ���Ӧ���ܷ�������У�______��ԭ���ȵ�ͭ˿����ʲô����_______��
��4����֤�Ҵ���������Ļ�ѧ������_______��
���𰸡�2CH3CH2OH��O2![]() 2CH3CHO��2H2O ���Ȳ��ֵ�ͭ˿���Ъ�Եع��������������ֱ���ٱ�� �¶� ��Ӧ�Կɼ������� �Կɿ���ԭ���Ȳ��ֵ�ͭ˿������ֱ�ڱ������� ʵ�������ж��װ��B��ʢ������ˮ���Թܣ�����ȡ��������Һ��������Ӧ��ʵ��[��������Cu(OH)2����Һ���ȵ�ʵ��]������֤���Ҵ���ͭ�Ĵ�����������ȩ�Ľ���
2CH3CHO��2H2O ���Ȳ��ֵ�ͭ˿���Ъ�Եع��������������ֱ���ٱ�� �¶� ��Ӧ�Կɼ������� �Կɿ���ԭ���Ȳ��ֵ�ͭ˿������ֱ�ڱ������� ʵ�������ж��װ��B��ʢ������ˮ���Թܣ�����ȡ��������Һ��������Ӧ��ʵ��[��������Cu(OH)2����Һ���ȵ�ʵ��]������֤���Ҵ���ͭ�Ĵ�����������ȩ�Ľ���
��������
(1)�����ȵ�ͭ˿�����Ҵ�������������ȩ��ˮ��
(2)����ʱ��Cu����������CuO��Ȼ��CuO�����Ҵ�������ȩ��Cu��ˮ��
(3)���ݴ���������Ӧ�Ƿ��ȷ�Ӧ�����жϣ�
(4)�Ҵ�������Ϊ��ȩ������ȩ���ļ��鷽������ʵ����ơ�
(1)�����ȵ�ͭ˿�����Ҵ�������������ȩ��ˮ����Ӧ�Ļ�ѧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2
2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
(2)����ʱ��Cu����������CuO��2Cu+O2![]() 2CuO��Ȼ��CuO�����Ҵ�������ȩ��Cu��ˮ���ظ�����������Ӧ����ɹ۲쵽A�����Ȳ��ֵ�ͭ˿���Ъ�Եع��������������ֱ�ڱ�������п���ʶ���ڸ�ʵ������У������������ʱ�μ��˻�ѧ��Ӧ��������ʶ�������������ʱ��Ҫһ�����¶ȣ��ʴ�Ϊ�����Ȳ��ֵ�ͭ˿���Ъ�Եع��������������ֱ�ڱ�죻�¶ȣ�
2CuO��Ȼ��CuO�����Ҵ�������ȩ��Cu��ˮ���ظ�����������Ӧ����ɹ۲쵽A�����Ȳ��ֵ�ͭ˿���Ъ�Եع��������������ֱ�ڱ�������п���ʶ���ڸ�ʵ������У������������ʱ�μ��˻�ѧ��Ӧ��������ʶ�������������ʱ��Ҫһ�����¶ȣ��ʴ�Ϊ�����Ȳ��ֵ�ͭ˿���Ъ�Եع��������������ֱ�ڱ�죻�¶ȣ�
(3)����������Ӧ�Ƿ��ȷ�Ӧ����Ӧ�ų��������ܹ�ά�ַ�Ӧ�������У���˳����ƾ��ƣ���Ӧ�Խ��У�ԭ���Ȳ��ֵ�ͭ˿�Կɿ���������ֱ�ڱ������ʴ�Ϊ����Ӧ�Կɼ������У��Կɿ���ԭ���Ȳ��ֵ�ͭ˿������ֱ�ڱ�������
(4)�Ҵ�������Ϊ��ȩ����ȩ����ȩ�������л�ԭ�ԣ��ܱ�������Һ������������ͭ����Һ��������֤��ȩ����IJ���Ϊ��ʵ�������ж��װ��B��ʢ����������ˮ���Թ��У��������Ƶ�������Һˮԡ���ȣ��۲��Թܱ����Ƿ��й������������ɣ���ȡB�е�Һ�����Թ��У��������Ƶ�������ͭ����Һ���ȣ��۲��Ƿ��к�ɫ�ij������ɣ��ʴ�Ϊ��ʵ�������ж��װ��B��ʢ������ˮ���Թܣ�����ȡ��������Һ��������Ӧ��ʵ��[��������Cu(OH)2����Һ���ȵ�ʵ��]������֤���Ҵ���ͭ�Ĵ�����������ȩ�Ľ��ۡ�

 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�����Ŀ��������������Ӱ�����ǵ�����ͽ�������˲�ȡ������Դ�ṹ���������ŵȴ�ʩ������PM2.5��SO2��NOx����Ⱦ����ش���������:
��. ������������������������������ķ�Ӧ֮һΪ��2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����ͬ�¶��£����������������з����÷�Ӧ�������Ϣ���±���ͼ��ʾ���ش��������⣺
N2O5(g)+O2(g)����ͬ�¶��£����������������з����÷�Ӧ�������Ϣ���±���ͼ��ʾ���ش��������⣺
���� | �� | �� |
�ݻ�/L | 1 | 1 |
�¶�/K | T1 | T2 |
��ʼ������ | 1molO3��2molNO2 | 1molO3��2molNO2 |
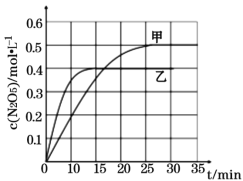
��0~15min���������з�Ӧ��ƽ�����ʣ�v(NO2) =____(������������λС��)��
�ڸ÷�Ӧ������ӦΪ____(����ȡ����ȡ�)��Ӧ��
��T1ʱƽ���������������ٳ���1molO3��2molNO2���ٴ�ƽ���NO2�İٷֺ�����____(�������С�����䡱)��
�ܷ�Ӧ��ϵ���¶�ΪT1ʱ��ƽ�ⳣ��Ϊ____��
���ں��º��������£�������������֤���÷�Ӧ�Ѿ��ﵽƽ�����____��
a�������ڻ������ѹǿ���ٸı�
b������2n molNO2��ͬʱ��������n molO3
c����������ƽ����Է����������ٸı�
d����������ܶȲ��ٸı�
II. ij��ѧС��������Ϻ��֪��2NO(g)��O2(g) ![]() 2NO2(g) �ķ�Ӧ���̷�������
2NO2(g) �ķ�Ӧ���̷�������
��2NO(g)��N2O2(g) (��)�� v1����k1����c2(NO)��v1����k1����c(N2O2)��
��N2O2(g)��O2(g)��2NO2(g) (��) v2����k2����c(N2O2)��c(O2)��v2����k2����c2(NO2)��
��ش��������⣺
��1����֪����2NO(g)��O2(g) ![]() 2NO2(g)��Ӧ���ʵ��Ƿ�Ӧ�ڣ���Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1____E2(���������������)��
2NO2(g)��Ӧ���ʵ��Ƿ�Ӧ�ڣ���Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1____E2(���������������)��
��2��һ���¶��£���Ӧ2NO(g)��O2(g) ![]() 2NO2(g)�ﵽƽ��״̬��д����k1����k1����k2����k2����ʾƽ�ⳣ���ı���ʽK��____��
2NO2(g)�ﵽƽ��״̬��д����k1����k1����k2����k2����ʾƽ�ⳣ���ı���ʽK��____��