题目内容
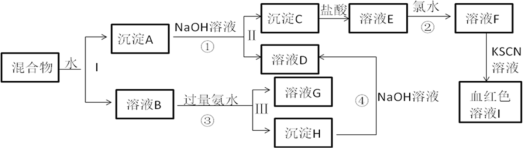
【题目】某混合物中含有KAl(SO4)2和另外两种金属氧化物,在一定条件下可实现下图所示物质间转化:
已知:Cl2+2Fe2+==2Fe3++2Cl-
请回答下列问题:
(1)沉淀H的化学式_________,框图中血红色物质是______(填化学式)
(2)Ⅰ、Ⅱ、Ⅲ分离操作中所需的玻璃仪器除烧杯、玻璃棒外还需要___________。
(3)反应①的离子方程式是____________。
(4)检验溶液G中金属阳离子的操作方法和现象是___________。
(5)若在E中加入KSCN溶液,溶液不变色,则沉淀C是________(填名称);
若在E中加入KSCN溶液,溶液变红色,为进一步确认沉淀C的成分,进行如下定量实验: 将沉淀C用5mol/L盐酸14mL恰好完全溶解,所得溶液还能吸收标准状况下56mL氯气,使其中Fe2+全部转化为Fe3+。则沉淀C可能的化学式是__________
【答案】Al(OH)3 Fe(SCN)3 漏斗 Al2O3 + 2OH- = 2AlO2- + H2O 焰色反应,隔蓝色的钴玻璃火焰呈紫色 氧化亚铁 Fe5O7
【解析】
(5)氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成H2O,由H原子、O原子守恒可知n(O)=n(H2O)=![]() n(HCl),所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=
n(HCl),所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=![]() [n(HCl)+2n(Cl2)],再根据Fe、O原子数目之比确定氧化物化学式;
[n(HCl)+2n(Cl2)],再根据Fe、O原子数目之比确定氧化物化学式;
结合(5)的计算,沉淀A为Al2O3和Fe5O7,溶液B为KAl(SO4)2,B与氨水反应生成沉淀H为Al(OH)3,溶液G中含有:K2SO4、(NH4)2SO4;沉淀A为Al2O3和Fe5O7,加NaOH溶液,得溶液D为NaAlO2,沉淀C为Fe5O7,溶于盐酸生成溶液E,E为FeCl2、FeCl3的混合物,再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液F成分为FeCl3,血红色物质I是Fe(SCN)3。
(1)KAl(SO4)2与氨水反应生成Al(OH)3,沉淀H的化学式Al(OH)3,FeCl3与KSCN反应生成血红色物质I是Fe(SCN)3,框图中血红色物质是Fe(SCN)3,故答案为:Al(OH)3;Fe(SCN)3;
(2)Ⅰ、Ⅱ、Ⅲ分离操作是过滤,所需的玻璃仪器除烧杯、玻璃棒外还需要漏斗。故答案为:漏斗;
(3)反应①的离子方程式是Al2O3 + 2OH- = 2AlO2- + H2O。故答案为:Al2O3 + 2OH- = 2AlO2- + H2O;
(4)检验溶液G中金属阳离子为钾离子,检验的操作方法和现象是:焰色反应,隔蓝色的钴玻璃火焰呈紫色。故答案为:焰色反应,隔蓝色的钴玻璃火焰呈紫色;
(5)若在E中加入KSCN溶液,溶液不变色,则沉淀C是氧化亚铁(填名称);故答案为:氧化亚铁;
氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成H2O,由H原子、O原子守恒可知n(O)=n(H2O)=![]() n(HCl)=
n(HCl)=![]() ×0.014L×5mol·L-1=0.035mol,,所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=
×0.014L×5mol·L-1=0.035mol,,所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=![]() [n(HCl)+2n(Cl2)]=
[n(HCl)+2n(Cl2)]=![]() ×(0.014L×5mol·L-1+2×
×(0.014L×5mol·L-1+2×![]() )=0.025mol,所以氧化物中n(Fe):n(O)=0.025mol:0.035mol=5:7,该氧化物的化学式为Fe5O7。
)=0.025mol,所以氧化物中n(Fe):n(O)=0.025mol:0.035mol=5:7,该氧化物的化学式为Fe5O7。
故答案为:Fe5O7。