题目内容
16.有下列各组物质:(A)S2和S4 (B)${\;}_{35}^{79}$Br和${\;}_{35}^{81}$Br (C)CH4和C8H18(D) CH3-CH2-CH2-CH3和
(E)
 和
和
①B组两物质互为同位素
②A组两物质互为同素异形体
③D组两物质互为同分异构体
④C组两物质互为同系物
⑤E组为同一物质.
分析 具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.同素异形体是同种元素形成的不同单质.同系物是有机化合物中具有同一通式、组成上相差一个或多个某种原子团、在结构与性质上相似的化合物系列.具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:(A)S2和S4是S元素的不同种单质,互为同素异形体;
(B)${\;}_{35}^{79}$Br和${\;}_{35}^{81}$Br均是溴元素的不同种原子,互为同位素;
(C)CH4和C8H18分子结构相同,组成上相差17个CH2原子团,属于同系物;
(D) CH3-CH2-CH2-CH3和 分子式相同,结构不同,属于同分异构体;
分子式相同,结构不同,属于同分异构体;
(E) 和
和 相当于甲烷中的两个H原子被2个溴原子取代,甲烷为四面体结构,故甲烷的二溴代物只有一种,故两者是同一种物质,
相当于甲烷中的两个H原子被2个溴原子取代,甲烷为四面体结构,故甲烷的二溴代物只有一种,故两者是同一种物质,
故答案为:B;A;D;C;E.
点评 本题主要考查的是同位素,同系物,同分异构体,同素异形体的概念,属于常考题类型,难度不大.

练习册系列答案
相关题目
7.1.0L 1.00mol•L-1H2SO4溶液与2.00L 1.00mol•L-1NaOH溶液完全反应,放出114.6kJ热量,则可推算出该条件下酸与碱反应的中和热为( )
| A. | 57.3 kJ•mol-1 | B. | 114.9 kJ•mol-1 | C. | 171.9 kJ•mol-1 | D. | 229.2 kJ•mol-1 |
4.下列关于电化学的说法中错误的是( )
| A. | 原电池的负极、电解池的阳极均发生氧化反应 | |
| B. | 原电池将化学能转化为电能,电解池将电能转化为化学能 | |
| C. | 电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 | |
| D. | 利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
11. A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
请回答下列问题:
(1)Z的化学式为NO2.乙的结构式为N≡N.
(2)B的最高价氧化物的电子式为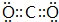 .
.
(3)用电子式表示A元素和E元素形成化合物的过程: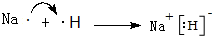 .
.
(4)G的单质与水反应的离子方程式Cl2+H2O?H++Cl-+HClO.
(5)F的单质与E的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时负极反应式为N2H4+4OH--4e-=N2↑+4H2O.
 A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.| C | D | |
| G |
(1)Z的化学式为NO2.乙的结构式为N≡N.
(2)B的最高价氧化物的电子式为
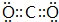 .
.(3)用电子式表示A元素和E元素形成化合物的过程:
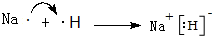 .
.(4)G的单质与水反应的离子方程式Cl2+H2O?H++Cl-+HClO.
(5)F的单质与E的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时负极反应式为N2H4+4OH--4e-=N2↑+4H2O.
1.下列说法正确的是( )
| A. | 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 | |
| B. | 煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | 聚氯乙烯塑料可制作保鲜膜、一次性食品袋 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |


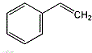 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.