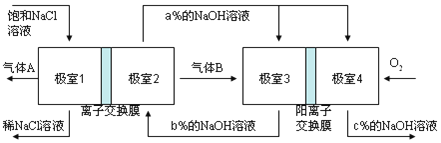
��Ŀ����
����Ŀ�������£�ʵ����1.0mol/L NH4HCO3 ��ҺpH=8.0��ƽ��ʱ̼�ķֲ�ϵ��������̼����Ũ��ռ��̼������Ũ��֮�͵ķ�������pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
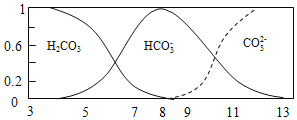
A. �����£�Kb(NH3H2O)>Ka1(H2CO3)>Ka2(H2CO3)
B. pH=13ʱ����Һ�в�����HCO3-��ˮ��ƽ��
C. pH��8��11 ʱ������pHֵ������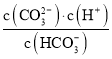 ����
����
D. pH=3ʱ����c(NH4+)+c(NH3H2O)=c(HCO3-)+c(H2CO3)+c(CO32-)
���𰸡�A
��������
A. ����Խ��Խˮ��ԭ����1.0mol/L NH4HCO3��ҺpH=8.0��˵��笠�ˮ��̶�С��̼��������ӣ�Ӧ��Kb(NH3H2O)��ka1(H2CO3)��Ka2(H2CO3)����A��ȷ��
B. ֻҪ����̼������Ӿʹ���HCO3-��ˮ��ƽ�⣬��B����
C. �¶Ȳ��䣬̼��������ӵĵ���ƽ�ⳣ�����䣬��C����
D. pH=3ʱ��NH4HCO3���������ӷ�Ӧ���ɶ�����̼������c(NH4+)+c(NH3H2O)��c(HCO3-)+c(CO32-)+c(H2CO3)����D����
��ѡA��

��ϰ��ϵ�д�
�����Ŀ