��Ŀ����
����Ŀ������β����ȼúβ������ɿ�����Ⱦ����Ҫԭ��֮һ����������β����ȼúβ���ǻ�����������Ҫ���⡣�ش��������⣺
��1������������ϵͳ�а�װ��Ԫ��ת�������ɷ�����Ӧ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����ij�ܱո���������ͨ�������CO��NO������������Ӧʱ��c(CO)���¶�(T)��ʱ��(t)�ı仯������ͼ��ʾ��
2CO2(g)+N2(g)����ij�ܱո���������ͨ�������CO��NO������������Ӧʱ��c(CO)���¶�(T)��ʱ��(t)�ı仯������ͼ��ʾ��
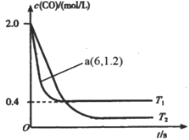
�پݴ��жϸ÷�Ӧ������ӦΪ________(��������������������)��Ӧ��
���¶�T1ʱ���÷�Ӧ��ƽ�ⳣ��K=_____����Ӧ����v=v��- v��=k��c2(NO)c2(CO)-k��c2(CO2)c(N2)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ���������a��![]() =________��
=________��
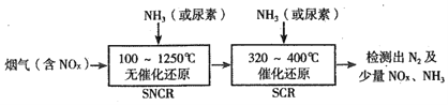
��2��SNCR-SCR����������һ�����͵ij�ȥ�����е������������������һ����ð�������������ԭ���������������ͼ��
��SNCR-SCR������������NH3����ԭ����ԭNO����Ҫ��ӦΪ4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)����H<0����������[CO(NH2)2]����ԭ����ԭNO2�Ļ�ѧ����ʽΪ______________��
����ϵ�¶�ֱ��Ӱ��SNCR����������Ч�ʣ���ͼ��ʾ��

SNCR��SCR������ȣ�SCR�����ķ�Ӧ�¶Ȳ���̫������ԭ����__________������ϵ�¶�ԼΪ925��ʱ��SNCR����Ч����ߣ�����ܵ�ԭ����______________��
���𰸡����� 80 648 4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O �¶�̫�ߣ��ή�ʹ������� ����925�淴Ӧ���ʽ���������925�治����������Ӧ�������
4CO2+7N2+8H2O �¶�̫�ߣ��ή�ʹ������� ����925�淴Ӧ���ʽ���������925�治����������Ӧ�������
��������
(2)���ȹ���ƽ�¶ȸ�T1��T2���¶�Խ��COŨ��Խ��˵������ƽ��������У�
���¶�T1ʱ��COƽ��Ũ��Ϊ0.4mol��L��1��������м�����ʽ����ƽ��Ũ�ȵõ��÷�Ӧ��ƽ�ⳣ��K=![]() ������ƽ��״̬��
������ƽ��״̬��![]() ����Ӧ����v=v��=v��=k��c2(NO)c2(CO)=kc2(CO2)c(N2)��
����Ӧ����v=v��=v��=k��c2(NO)c2(CO)=kc2(CO2)c(N2)��![]() ��
��
(3)��������[CO(NH2)2]����ԭ����ԭNO2�ķ�Ӧ���ɶ�����̼��������ˮ��
��SCR�����ķ�Ӧ�¶Ȳ���̫�ߣ����´������Խ��ͣ�����ϵ�¶�ԼΪ925��Cʱ��SNCR����Ч����ߣ�SNCR��������������¶�ѡ��925���������925��ʱ����Ч�ʸߣ�������Ũ�Ƚ�С��
��ͼ�������֪���ȹ���ƽ�¶ȸ�T1��T2���¶�Խ��COŨ��Խ��˵������ƽ��������У��淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
���¶�T1ʱ��COƽ��Ũ��Ϊ0.4mol��L-1��������м�����ʽ�õ�ƽ��Ũ�ȼ���ƽ�ⳣ����
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
��ʼ��(mol��L-1) 2 2 0 0
�仯��(mol��L-1) 1.6 1.6 1.6 0.8
ƽ����(mol��L-1) 0.4 0.4 1.6 0.8
ƽ�ⳣ��K=![]() =80��
=80��
ƽ��״̬�£�k��c2(NO)c2(CO)=k��c2(CO2)c(N2)��![]() =K=80��
=K=80��
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
��ʼ��(mol��L-1) 2 2 0 0
�仯��(mol��L-1) 0.8 0.8 0.8 0.4
a����(mol��L-1) 1.2 1.2 0.8 0.4
![]() =80��
=80��![]() =648��
=648��
(3)����NH3����ԭ����ԭNO����Ҫ��ӦΪ4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)����H��0����������[CO(NH2)2]����ԭ����ԭNO2�Ļ�ѧ����ʽΪ��4CO(NH2)2]+6NO2![]() 4CO2+7N2+8H2O��
4CO2+7N2+8H2O��
��ͼ���֪SNCR����������������¶�Ϊ��925��C���ң�SNCR��SCR������ȣ�SCR�����ķ�Ӧ�¶Ȳ���̫�ߣ���ԭ�����¶ȹ��ߣ��������Խ��ͣ�����ϵ�¶ȵ���900��ʱ��SNCR����Ч�����¶����߶�����Ӧ���ʽ���������ϵ�¶ȸ���950��ʱ��SNCR����Ч�����Խ��ͣ�������������Ӧ������С�

����Ŀ����֪![]() ʱ�й�����ĵ���ƽ�ⳣ�����±���
ʱ�й�����ĵ���ƽ�ⳣ�����±���
���ữѧʽ | HX | HY |
|
����ƽ�ⳣ�� |
|
|
|
�����ƶ���ȷ����![]()
A.HX��HY������������ԣ�![]()
B.��ͬ��������Һ�ļ��ԣ�![]()
C.���![]() ��������
��������![]()
D.HX��![]() ��Ӧ�������ݲ���
��Ӧ�������ݲ���
����Ŀ��![]() ʱ����
ʱ����![]() ��ijһԪ��HA��
��ijһԪ��HA��![]() ��NaOH��Һ�������ϣ���ַ�Ӧ��������Һ�в�������Ũ�����±�������˵������ȷ����
��NaOH��Һ�������ϣ���ַ�Ӧ��������Һ�в�������Ũ�����±�������˵������ȷ����![]()
�� |
|
|
|
Ũ�� |
|
|
|
A.������Һ�У�![]()
B.![]() ʱ��ˮ�����ӻ�
ʱ��ˮ�����ӻ�![]()
C.![]() ʱ��һԪ��HA�ĵ��볣��
ʱ��һԪ��HA�ĵ��볣��![]()
D.![]() ʱ��
ʱ��![]() ��Һ��
��Һ��![]() ��ˮ����Ϊ
��ˮ����Ϊ![]()