题目内容
【题目】下列说法正确的是( )
A.T℃时,pH=7的溶液一定呈中性
B.已知反应2NO2(g)![]() N2O4(g)在低温下可自发进行,则△H>0
N2O4(g)在低温下可自发进行,则△H>0
C.在0.1molL-1的NH4Cl溶液中:c(NH4+)+c(NH3H2O)=0.1molL-1
D.在Na2CO3溶液中:c(Na+)=2c(CO32-)
【答案】C
【解析】
A.25℃下,溶液的pH=7,则溶液呈现中性,但是T℃不一定是25℃,A错误;
B.反应2NO2(g)![]() N2O4(g),是一个气体体积减小的反应,△S<0,根据△G=△H-T△S<0,则△H<0,B错误;
N2O4(g),是一个气体体积减小的反应,△S<0,根据△G=△H-T△S<0,则△H<0,B错误;
C.在NH4Cl溶液中,NH4++H2O![]() NH3·H2O+H+,根据物料守恒,有c(NH4+)+c(NH3H2O)=0.1molL-1,C正确;
NH3·H2O+H+,根据物料守恒,有c(NH4+)+c(NH3H2O)=0.1molL-1,C正确;
D.Na2CO3溶液中,CO32-会发生水解,生成HCO3-和H2CO3,则有物料守恒,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D错误。
答案选C。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】下表是几种常见弱酸的电离平衡常数(25℃ )
化学式 | H2CO3 | CH3COOH | HClO |
电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 1.8×10-5 | 3.0×10-8 |
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是_____________________________________。
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+)B.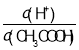 C.c(H+)c(OH﹣)D.
C.c(H+)c(OH﹣)D.![]() E.
E.![]()
(3)25℃时,等浓度的Na2CO3、CH3COONa和NaClO三种溶液的pH从小到大依次是_____________________________________。
(4)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,溶液中离子浓度大小关系:_________________
(5)下列反应不能发生的是______(填字母)。
a.![]() +2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.![]() +2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=
+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=![]() +2HClO
+2HClO