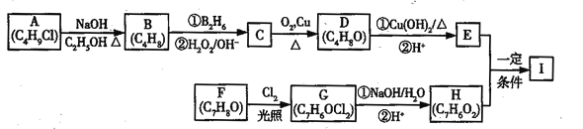
题目内容
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是( )
W(s)+3H2O(g),下列说法不正确的是( )
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)、H2(g)的生成速率减小
【答案】C
【解析】
A.将体积缩小,各气体的浓度增大,反应速率加快,A项正确;
B.体积不变,充入氩气,H2(g)、H2O(g)的浓度不变,反应速率不变,B项正确;
C.压强不变,充入氖气,体积增大,H2(g)、H2O(g)的浓度减小,反应速率减慢,C项错误;
D.压强不变,充入氖气,体积增大,H2(g)、H2O(g)的浓度减小,反应速率减慢,D项正确;
故答案为C。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目