题目内容
【题目】已知:H2(g)+F2(g)=2HF(g) △H1=-270kJmol-1。下列说法不正确的是( )
A.1molH2(g)与1molF2(g)的键能之和比2molHF(g)的键能高270kJ·mol-1
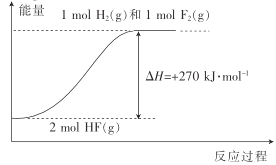
B.HF(g)分解为H2(g)与F2(g)的反应过程的能量变化可用如图来表示
C.若反应中有20gHF(g)生成,则放出135kJ热量
D.若H2(g)+Cl2(g)=2HCl(g) △H2=-QkJ·mol-1,则Q<270
【答案】A
【解析】
A.根据△H=反应物的总键能-生成物的总键能,根据反应H2(g)+F2(g)=2HF(g) △H1=-270kJ·mol-1,则反应物1molH2(g)与1molF2(g)的键能之和比生成物2molHF(g)的总键能低270kJ,错误,A符合题意;
B.根据反应,可知2molHF(g)分解生成1molH2(g)和1molF2(g)吸收270kJ热量,可用图示表示,正确,B不符合题意;
C.20gHF(g),其物质的量![]() ,根据反应,生成2molHF(g)放出270kJ热量,现生成1molHF(g),则放出135kJ热量,正确,C不符合题意;
,根据反应,生成2molHF(g)放出270kJ热量,现生成1molHF(g),则放出135kJ热量,正确,C不符合题意;
D.同主族非金属元素的非金属性随着核电荷数的增大而减弱,非金属性越强,气态氢化物的稳定性越强。一般情况下,物质越稳定,具有的能量越低,因此1molH2(g)分别和1molF2(g)、1molCl2(g)反应,由于生成HF(g)更稳定,能量更低,放出的热量更多,则△H2>△H1,Q<270,正确,D不符合题意。
答案选A。

练习册系列答案
相关题目