题目内容
17.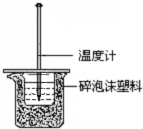 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
分析 (1)根据量热计的构造来判断该装置的缺少仪器;中和热测定实验成败的关键是保温工作;
(2)不盖硬纸板,会有一部分热量散失;
(3)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,
故答案为:环形玻璃搅拌棒;减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,焓变是负值,所以焓变会偏大,故答案为:偏大;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,温度差为:3.15℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,温度差为:3.05℃;三次温度差平均值为:3.1℃;用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH进行反应,生成水的物质的量为0.04L×0.50mol/L=0.02mol,溶液的质量为80mL×1g/cm3=80g,温度变化的值为△T=3.1℃,则生成0.02mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×3.1℃=1036.64J,即1.03664KJ,所以实验测得的中和热△H=-$\frac{1.03664KJ}{0.02mol}$=-51.83kJ/mol;
故答案为:-51.83kJ/mol.
点评 本题主要考查热中和热概念、测定原理及反应热的计算,题目难度中等,注意理解中和热的概念以及测定反应热的误差等问题.

| A. | 干冰、石灰石、氧化钙 | B. | 液氯、硝酸、纯碱 | ||
| C. | 水、烧碱、食盐 | D. | 氧气、盐酸、熟石灰 |
| A. | 1mol任何物质所含的分子数均为NA个 | |
| B. | 14 g氮气所含的N原子数为NA个 | |
| C. | 标准状况下,22.4 L SO3中所含分子数为NA个 | |
| D. | 在钠与氯气的反应中,1 mol氯气失去电子的数目为2NA个 |
 如图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确的是( )
如图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确的是( )| A. | 原子半径比较:rZ>rY>rX | |
| B. | 气态氢化物的还原性比较:W>R | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | 含Z元素的盐溶液一定显示酸性 |

| A. | 反应①中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 反应②属于非氧化还原反应 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 根据反应⑤可判断还原性:Al>Mn |
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3 - SO42- I- |
Ⅰ.取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2 溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+.
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O.
(3)甲同学最终确定原溶液中所含阳离子有Mg2+、Al3+,阴离子有Cl-、I-、NO3-、SO42-;并据此推测原溶液应该呈酸性,原因是Mg2++2H2O?Mg(OH)2+2H+、Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)另取100mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为Mg2++2OH-═Mg(OH)2↓、Al3++4OH-═AlO2-+2H2O.充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g.