题目内容
7.A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中A与D同主族、C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液变红.据此回答下列问题:(1)F元素形成的高价基态离子的核外电子排布式为1s22s22p63s23p23d9;C、D、E三元素原子均能形成简单离子,其离子半径大小顺序为S2->O2->Na+(用离子符号表示);
(2)A与C形成的10电子分子中含的化学键类型为σ键(填σ键或π键),分子中心原子的轨道杂化类型为sp3,其化合物晶体类型为分子晶体;化合物A2C和A2E中,沸点较高的是H2O(填分子式);
(3)向含1mol A2E的水溶液中加入等物质的量的D2C2,有黄色沉淀生成,写出离子方程式Na2O2+H2S═2Na++2OH-+S↓:
(4)常温常压下,有23g液态化合物B2A6C与足量的C的单质充分反应,生成BC2气体和A2C液体,同时放出683.5kJ的热量,该反应的热化学方程式为:C2H6O(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-1367.0 kJ•mol-1.
分析 A、B、C、D、E、F是原子序数依次递增的前四周期元素,C与E同主族,且E的原子序数是C的两倍,第二三周期同一主族元素原子序数相差8,则C是O元素,E是S元素;B的原子序数小于C,B与C的最外层电子数之比2:3,则B最外层电子数是4,故B为碳元素;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液变红,说明该反应中有强碱生成,D的原子序数大于8而小于16,所以D是Na元素;A与D同主族,A的原子序数最小,且能和B或C形成10电子分子,所以A是H元素;F原子的最外层电子数与A相同,其余各层均充满,则F的原子序数是2+8+18+1=29,为Cu元素,据此解答.
解答 解:A、B、C、D、E、F是原子序数依次递增的前四周期元素,C与E同主族,且E的原子序数是C的两倍,第二三周期同一主族元素原子序数相差8,则C是O元素,E是S元素;B的原子序数小于C,B与C的最外层电子数之比2:3,则B最外层电子数是4,故B为碳元素;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液变红,说明该反应中有强碱生成,D的原子序数大于8而小于16,所以D是Na元素;A与D同主族,A的原子序数最小,且能和B或C形成10电子分子,所以A是H元素;F原子的最外层电子数与A相同,其余各层均充满,则F的原子序数是2+8+18+1=29,为Cu元素.
(1)Cu原子核外有29个电子,铜原子失去两个电子变为铜离子,根据构造原理,Cu2+离子核外电子排布式为1s22s22p63s23p23d9;离子的电子层数越多,其离子半径越大,电子层结构相同的离子中,离子半径随着原子序数的增大而减小,所以离子半径大小顺序是S2->O2->Na+,
故答案为:1s22s22p63s23p23d9;S2->O2->Na+;
(2)A与C形成的10电子分子为H2O,水分子中O原子与H原子之间形成单键,属于σ键,水分子中价层电子对个数是4,所以氧原子采用sp3杂化,冰的构成微粒是分子,所以为分子晶体,水分子和硫化氢结构相似,但水分子中含有氢键,导致水的沸点较高,
故答案为:σ键;sp3;分子晶体;H2O;
(3)过氧化钠具有强氧化性,硫化氢具有还原性,过氧化钠和硫化氢反应生成氢氧化钠和硫单质,离子方程式为:Na2O2+H2S═2Na++2OH-+S↓,故答案为:Na2O2+H2S═2Na++2OH-+S↓;
(4)23gC2H6O的物质的量=$\frac{23g}{46g/mol}$=0.5mol,与足量的氧气充分反应生成CO2气体和H2O液体,同时放出683.5kJ的热量,有1molC2H6O完全燃烧放出的热量为1367.0 kJ,所以该反应热化学方程式为:C2H6O(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-1367.0 kJ•mol-1,
故答案为:C2H6O(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-1367.0 kJ•mol-1.
点评 本题考查了位置结构和性质的关系,正确推断元素是解本题关键,过氧化钠和硫化氢能发生氧化还原反应为易错点,难度中等.

| 有机物 | 氢氧化钠 | 银氨溶液 | 新制氢氧化铜 | 金属钠 |
| A | 发生中和反应 | 不反应 | 溶解 | 放出氢气 |
| B | 不反应 | 发生银镜反应 | 生成红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 发生银镜反应 | 生成红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
| A. | 容器内的压强不随时间而变化 | |
| B. | B的正反应速率等于C的逆反应速率 | |
| C. | A的质量不再改变 | |
| D. | 单位时间内生成2a mol A,同时消耗a mol C |
烯烃复分解反应中的催化剂是金属卡宾(如CH2=M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈.随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴.后者会继续寻找下一个烯烃分子,再次“交换舞伴”.把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是( )
| A. | C6H5CH2CH=M | B. | CH2=CH2 | ||
| C. | C6H5CH2CH2C6H5 | D. | C6H5CH2CH=CHCH2C6H5 |

下列有关说法正确的是( )
| A. | 向溶液乙中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| B. | 向溶液乙中滴加少量氢氧化钠溶液,一定出现红褐色沉淀 | |
| C. | 向溶液甲中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| D. | 该矿石一定为赤铁矿 |
| A. | 2V(正)(N2)=V(逆)(NH3) | B. | V(正)(N2)=3V(正)(H2) | ||
| C. | 2V(正)(H2)=3V(逆)(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
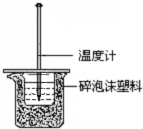 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |