题目内容
9.实验室将28gFe与足量稀盐酸混合,充分反应后:①生成FeCl2的物质的量为多少?
②消耗HCl的质量是多少克?
③生成的气体在标准状况下所占的体积是多少?
分析 n(Fe)=$\frac{28g}{56g/mol}$=0.5mol,发生反应:Fe+2HCl═FeCl2+H2↑,根据方程式计算FeCl2、HCl、H2物质的量,根据m=nM计算HCl的质量,根据V=nVm计算氢气体积.
解答 解:n(Fe)=$\frac{28g}{56g/mol}$=0.5mol,发生反应:Fe+2 HCl═FeCl2+H2↑,
①由反应可知,n(Fe)=n(FeCl2)=0.5mol,
答:生成FeCl2的物质的量为0.5mol;
②由反应可知,n(HCl)=2n(Fe)=1mol,HCl的质量为1mol×36.5g/mol=36.5g,
答消耗HCl的质量是36.5克;
③由反应可知,n(Fe)=n(H2)=0.5mol,标况下体积为0.5mol×22.4L/mol=11.2L,
答:生成的气体在标准状况下所占的体积是11.2L.
点评 本题考查化学反应方程式的计算,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
19.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g)达平衡的标准是:(分别用V(正)表示正反应速率,V(逆)表示逆反应速率)( )
| A. | 2V(正)(N2)=V(逆)(NH3) | B. | V(正)(N2)=3V(正)(H2) | ||
| C. | 2V(正)(H2)=3V(逆)(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
17.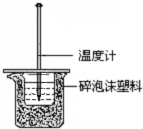 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
假设0.50mol/L盐酸和0.55mol/LNaOH溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).依据实验数据计算,生成1mol水时的反应热△H=-51.83kJ/mol.
 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
4.一种新型的灭火剂叫1211,其分子式是CF2ClBr,命名方法是按碳、氟、氯、溴的顺序分别以阿拉伯数字表示相应元素的原子数目(末尾的0可略去).按此原则,下列几种新型灭火剂的命名不正确的是( )
| A. | CF3Br-1301 | B. | C2F4Cl2-242 | C. | CF2Br2-122 | D. | C2Cl2Br2-2022 |
14.2.3g纯净物金属钠在干燥空气中被氧化后得到3.5g固体,由此可判断其氧化产物是( )
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
1.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇(CH3CH2OH)已成为现实:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g).下列叙述错误的是( )
| A. | 使用Cu-Zn-Fe催化剂可大大提高生产效率 | |
| B. | 升高温度,该反应平衡常数K一定增大 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O,可提高CO2和H2的利用率 |
18.在标准状况下,相同质量的下列气体中体积最小的是( )
| A. | Cl2 | B. | N2 | C. | H2 | D. | CO2 |
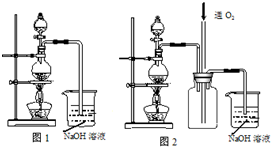 硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).
硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).