题目内容
8.下列各组物质中,依次属于单质、酸、盐的一组是( )| A. | 干冰、石灰石、氧化钙 | B. | 液氯、硝酸、纯碱 | ||
| C. | 水、烧碱、食盐 | D. | 氧气、盐酸、熟石灰 |
分析 单质是由同种元素组成的纯净物;酸是电离出来的阳离子全部是氢离子的化合物;盐是电离出金属离子和酸根离子的化合物.
解答 解:A.干冰属于氧化物;石灰石属于盐;氧化钙属于氧化物,故A错误;
B.液氯属于单质;硝酸属于酸;纯碱属于盐,故B正确;
C.水属于氧化物;烧碱属于碱;食盐属于盐,故C错误;
D.氧气属于单质;盐酸是氯化氢的水溶液属于混合物;熟石灰属于碱,故D错误;
故选D.
点评 本题考查单质、酸、盐的定义,难度不大,注意知识的积累.

练习册系列答案
相关题目
18.在一定温度下,反应:2A(s)+2B(g)?C(g)+D(g)在恒容的密闭容器中进行,能说明该反应已经达到平衡的是( )
| A. | 容器内的压强不随时间而变化 | |
| B. | B的正反应速率等于C的逆反应速率 | |
| C. | A的质量不再改变 | |
| D. | 单位时间内生成2a mol A,同时消耗a mol C |
19.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g)达平衡的标准是:(分别用V(正)表示正反应速率,V(逆)表示逆反应速率)( )
| A. | 2V(正)(N2)=V(逆)(NH3) | B. | V(正)(N2)=3V(正)(H2) | ||
| C. | 2V(正)(H2)=3V(逆)(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
16.工业上制取金刚砂的化学反应方程式如下:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
3.已知阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 16g CH4与18 g NH4+ 所含电子数相等 | |
| B. | 1molNa2O2与足量水反应转移2NA个电子 | |
| C. | 常温下2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
13.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )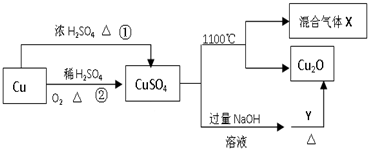

| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可以是酒精溶液 |
17.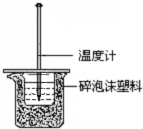 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
假设0.50mol/L盐酸和0.55mol/LNaOH溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).依据实验数据计算,生成1mol水时的反应热△H=-51.83kJ/mol.
 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
18.在标准状况下,相同质量的下列气体中体积最小的是( )
| A. | Cl2 | B. | N2 | C. | H2 | D. | CO2 |