题目内容
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
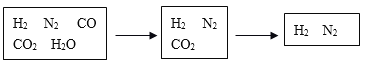
(1)步骤ⅰ,发生的是CO变换反应。
①CO变换反应的化学方程式是____________________________________。
②一定条件下,向体积固定为1 L的密闭容器中充入一定量半水煤气,发生CO变换反应。下图表示氢气与氮气的平衡体积比[V(H2):V(N2)]随外部条件X的变化关系。
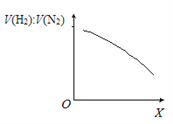
Ⅰ.X代表的物理量是______________________________。
Ⅱ.CO变换反应的△H _____0(填“>”或“<”),判断的依据是_____________________________。
③若用a、b、c、d 分别代表CO变换反应中相关化学键:H-H、H-O、![]() 、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是
、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是![]() 。消耗1mol CO时,该反应的热效应 △H = _______________。
。消耗1mol CO时,该反应的热效应 △H = _______________。
(2)步骤ⅱ中,用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2。
①当溶液pH降至10的过程中(无沉淀析出),溶液中离子浓度关系正确的是________(选填字母)。
a.c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L
b.c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
c.c(Na+)>c(CO32-)>c(HCO3-)
②当脱除液失效时,请设计一种可使其再生的方法(结合化学方程式说明):___________________________。
【答案】 CO +H2O(g) =CO2+H2 温度 < 温度升高时,平衡向吸热方向移动,氢气与氮气的体积比减小 c+2b-2d-a b 2NaHCO3 ![]() Na2CO3 + CO2↑ +H2O
Na2CO3 + CO2↑ +H2O
【解析】试题分析:(1)①CO变换反应是CO与H2O(g)反应生成CO2和H2;②根据图像,随X的增大,V(H2):V(N2)减小,说明氢气减少,CO +H2O(g) =CO2+H2反应逆向进行,根据影响平衡移动的因素分析;③△H=反应物的总键能-生成物的总键能;(2)①用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2,Na2CO3转化为NaHCO3。②当脱除液完全生成碳酸氢钠时失效,加热可使碳酸氢钠分解为碳酸钠;
解析:(1)①CO变换反应是CO与H2O(g)反应生成CO2和H2,反应方程式是CO +H2O(g) =CO2+H2;②Ⅰ. 根据影响平衡移动的因素,增大压强,该反应平衡不移动,改变温度平衡移动;Ⅱ.随温度升高,V(H2):V(N2)减小,说明氢气的减少,CO +H2O(g) =CO2+H2反应逆向进行,所以CO变换反应的△H<0;③△H=反应物的总键能-生成物的总键能,消耗1mol CO时,该反应的热效应 △H =c+2b-2d-a;(2)①用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2,Na2CO3转化为NaHCO3;根据物料守恒,原溶液中c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L,吸收一定量CO2后,c(CO32-)+c(HCO3-) + c(H2CO3) >2.0 mol/L,故a错误;根据电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故b正确;溶液中有碳酸氢钠生成,所以c(HCO3-)可能大于c(CO32-),故c错误。②当脱除液完全生成碳酸氢钠时失效,加热可使碳酸氢钠分解为碳酸钠,反应方程式是2NaHCO3 ![]() Na2CO3 + CO2↑ +H2O;
Na2CO3 + CO2↑ +H2O;

【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
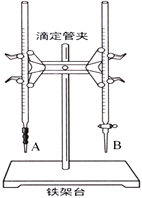
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
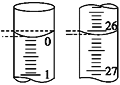
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
