题目内容
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
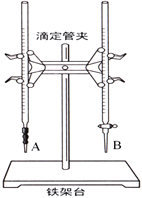
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
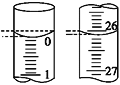
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
【答案】 A 检查是否漏水 溶液由黄色变为橙色,且在半分钟内不变色 D 26.10 ![]() =
=![]() =26.10 mL,c(NaOH)=
=26.10 mL,c(NaOH)=![]() =0.104 4 mol·L-1
=0.104 4 mol·L-1
【解析】(1)A是碱式滴定管,使用滴定管前必须进行检查滴定管是否漏水;(2)选择甲基橙作指示剂,用标准的盐酸滴定待测的NaOH溶液时,当出现溶液由黄色变为橙色,且在半分钟内不变色时,说明达到滴定终点;(3)A.酸式滴定管未用标准盐酸润洗,标准液浓度减小,滴加盐酸体积增大,就所测NaOH溶液的浓度数值偏高,A错误;B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,没有影响,B错误;C.酸式滴定管在滴定前有气泡,滴定后气泡消失,滴加盐酸体积增大,就所测NaOH溶液的浓度数值偏高,C错误;D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,滴加盐酸体积减小,就所测NaOH溶液的浓度数值偏低,D正确。答案选D。(4)所用盐酸溶液的体积为26.10mL;(5)因为第二组实验中,滴加盐酸的体积偏差太大,舍去,则二次实验盐酸体积的平衡值为:![]() =
=![]() =26.10 mL,则c(NaOH)=
=26.10 mL,则c(NaOH)=![]() =0.104 4 mol·L-1。
=0.104 4 mol·L-1。

 名校课堂系列答案
名校课堂系列答案【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
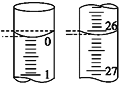
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
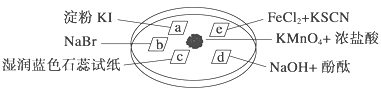
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D