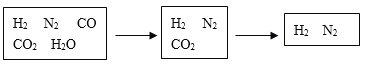
题目内容
【题目】短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,X的族序数等于周期数,Y与Z最外层电子数之和为10。下列说法不正确的是
A. X的最高价氧化物的水化物能溶解在Z的最高价氧化物的水化物溶液中
B. W、X、Z的简单离子均能促进水的电离
C. W的氢化物与X、Y、Z的氧化物均不反应
D. 原子半径:X>Y>Z>W
【答案】C
【解析】短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,则W为F;X的族序数等于周期数,则X为![]() ,Y与Z最外层电子数之和为10,且应为第三周期元素,则Y为Si,Z为S 。综上,W、X、Y、Z分别为F、Al、Si、S;X的最高价氧化物的水化物为Al(OH)3,Z的最高价氧化物的水化物为H2SO4,二者可以发生反应,A正确;W、Z的离子为弱酸对应的阴离子F-、S2-;X的离子为弱碱对应的阳离子Al3+,均可发生水解反应,均能促进水的电离,B正确;W的氢化物和Y的氧化物分别为HF和SiO2,两者可以发生反应,C错误;根据同周期原子半径逐渐减小,且电子层数越多,原子半径越大,可以得出四种元素的原子半径的大小关系为:X>Y>Z>W,D正确;正确选项C。
,Y与Z最外层电子数之和为10,且应为第三周期元素,则Y为Si,Z为S 。综上,W、X、Y、Z分别为F、Al、Si、S;X的最高价氧化物的水化物为Al(OH)3,Z的最高价氧化物的水化物为H2SO4,二者可以发生反应,A正确;W、Z的离子为弱酸对应的阴离子F-、S2-;X的离子为弱碱对应的阳离子Al3+,均可发生水解反应,均能促进水的电离,B正确;W的氢化物和Y的氧化物分别为HF和SiO2,两者可以发生反应,C错误;根据同周期原子半径逐渐减小,且电子层数越多,原子半径越大,可以得出四种元素的原子半径的大小关系为:X>Y>Z>W,D正确;正确选项C。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
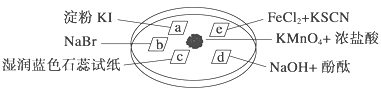
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D