题目内容
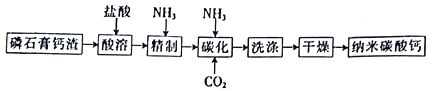
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有___________(填字母)。
A.粉碎磷石膏钙渣 B.增大盐酸浓度 C.适当降低温度 D.缩短酸溶时间
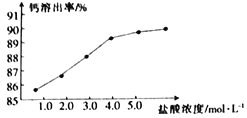
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为___________。
(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去___________(填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式___________(填化学式);碳化时发生反应的化学方程式为___________________________________________。
(5)把CaCO3浊液滴入1.0mol·L-1 的Na2SO3溶液中,能否产生CaSO3沉淀?___________。若不能,说明原因;若能,请从定量的角度简述判断依据:___________________________________。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___________。
【答案】 AB 4.0 mol·L-1 Fe3+、Al3+ NH3 CaCl2+H2O+2NH3+CO2=CaCO3↓+2NH4Cl 能 由![]() =50 可知,当CaSO3与CaCO3 的混合液中c(SO32-)>50c(CO32-)时.即发生由CaCO3向CaSO3的转变 取少量样品和水混合形成分散系.用一束光照射,若出现一条光亮的通路,则是纳米级.否则不是
=50 可知,当CaSO3与CaCO3 的混合液中c(SO32-)>50c(CO32-)时.即发生由CaCO3向CaSO3的转变 取少量样品和水混合形成分散系.用一束光照射,若出现一条光亮的通路,则是纳米级.否则不是
【解析】(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有将磷石膏钙渣粉碎、增大盐酸浓度、适当升高温度、延长酸溶时间等,故选AB;
(2)根据图示,盐酸的浓度为4.0mol/L时,滤液中钙溶出率已经较大,再增大盐酸浓度,钙溶出率增加缓慢,成本上不划算,故答案为:4.0mol/L;
(3)向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要是使Fe3+、Al3+形成沉淀而除去,故答案为:Fe3+、Al3+;
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2的通入量,由于二氧化碳在水中的溶解度减小,而氨气极易溶于水,因此先通入氨气,后通入二氧化碳;碳化时氯化钙与二氧化碳和氨气反应生成碳酸钙沉淀和氯化铵,反应的化学方程式为CaCl2+H2O+2NH3+CO2=CaCO3↓+2NH4Cl,故答案为:NH3;CaCl2+H2O+2NH3+CO2=CaCO3↓+2NH4Cl;
(5)由![]() =
=![]() =50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变,把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3Ca2++CO32-向着溶解的方向移动,导致CaCO3溶解,故答案为:能,由
=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变,把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3Ca2++CO32-向着溶解的方向移动,导致CaCO3溶解,故答案为:能,由![]() =50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;
=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;
(6)判断所得碳酸钙样品颗粒是否为纳米级,可以根据胶体的性质检验,方法为取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是,故答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。