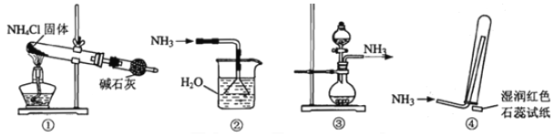
题目内容
【题目】已知某纯碱样品中含有杂质氯化钠,为测定样品中纯碱的质量分数,可用如图装置进行实验。
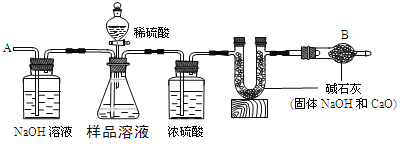
主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g样品放入锥形瓶中,加适量蒸馏水溶解,得到样品溶液
③称量盛有碱石灰的U型管的质量为b g
④由分液漏斗滴入5%的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量空气
⑥再次称量盛有碱石灰的U型管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,称量其质量为d g
请回答下列问题:
(1)步骤③称量用的主要仪器是_________________________
(2)锥形瓶中发生反应的离子方程式为_____________________________
(3)装置中干燥管B的作用是_____________________________
(4)如果将分液漏斗中的硫酸换成相同浓度的盐酸,测试的结果_______(填偏高、偏低或不变)
(5)步骤⑤的目的是_______________________
(6)步骤⑦的目的是_______________________
(7)该样品中纯碱的质量分数的计算式为_______________________
【答案】 托盘天平(或天平) CO32—+2H+=CO2↑+H2O 防止空气中的CO 2 和水蒸气进入U型管中 偏高 把反应产生的CO 2 全部导入U型管中,被碱石灰充分吸收 判断反应产生的CO 2 是否全部排出,并被U型管中的碱石灰吸收 ![]()
【解析】本题考查实验方案设计与评价,(1)称量物品时,需要用的仪器是托盘天平;(2)锥形瓶放入药品是纯碱样品和稀硫酸,发生的离子反应方程式为CO32-+2H+=CO2↑+H2O;(3)因为此实验测量纯碱的质量分数,需要通过测量CO2的质量进行计算,而空气中含有CO2和水蒸气,因此干燥管的作用是防止空气中的CO2和水蒸气进入U型管中;(4)因为盐酸具有挥发性,因此产生的CO2中混有HCl,通过浓硫酸出来的气体为CO2和HCl,HCl被U型管吸收,因此所测碳酸钠的纯度偏高;(5)锥形瓶、洗气瓶中含有未被吸收的CO2,因此鼓入一定量的空气目的是把反应产生CO2全部被U型管中药品吸收;(6)步骤⑦的目的是判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收;(7)根据步骤,CO2的质量为(d-b)g,根据碳元素守恒,Na2CO3物质的量为(d-b)/44mol,因此纯碱的纯度为106(d-b)/44a×100%。

【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
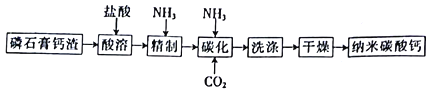
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有___________(填字母)。
A.粉碎磷石膏钙渣 B.增大盐酸浓度 C.适当降低温度 D.缩短酸溶时间
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为___________。
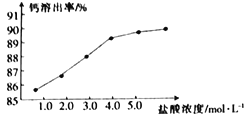
(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去___________(填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式___________(填化学式);碳化时发生反应的化学方程式为___________________________________________。
(5)把CaCO3浊液滴入1.0mol·L-1 的Na2SO3溶液中,能否产生CaSO3沉淀?___________。若不能,说明原因;若能,请从定量的角度简述判断依据:___________________________________。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___________。
【题目】珍珠的主要成分是一种钙盐。将其加入稀盐酸中,有气泡产生,生成的气体无气味,而且能使澄清石灰水变浑浊,则珍珠的主要成分是
A. CaCO3 B. CaCl2 C. Ca(OH)2 D. CaSO4
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小