题目内容
【题目】某强氧化剂XO(OH)2+被Na2SO3还原。如果还原2.4×10-3molXO(OH) 2+,需用30mL0.2mol·L-1的Na2SO3溶液,那么X元素被还原后的价态是( )
A.-1B.0C.+1D.+2
【答案】B
【解析】
Na2SO3还原2.4×10-3molXO(OH)2+到X元素的低价态,则Na2SO3被氧化为Na2SO4,反应中S元素的化合价由+4价升高为+6价,令X元素在还原产物中的化合价为a,由得失电子守恒可知,2.4×10-3mol×(5-a)=0.03L×0.2molL-1×(6-4),解得a=0,故选B。

【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
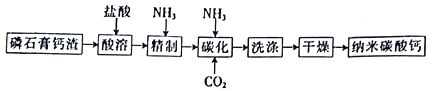
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有___________(填字母)。
A.粉碎磷石膏钙渣 B.增大盐酸浓度 C.适当降低温度 D.缩短酸溶时间
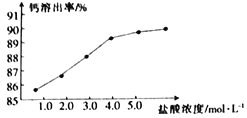
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为___________。
(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去___________(填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式___________(填化学式);碳化时发生反应的化学方程式为___________________________________________。
(5)把CaCO3浊液滴入1.0mol·L-1 的Na2SO3溶液中,能否产生CaSO3沉淀?___________。若不能,说明原因;若能,请从定量的角度简述判断依据:___________________________________。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___________。
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小