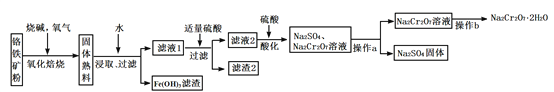
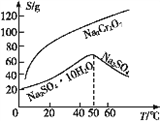
题目内容
【题目】已知:短周期元素A、B、C、D、E的原子序数依次增大。
①C的简单气态氢化物遇湿润的红色石蕊试纸变蓝色;
②A与D可以形成原子个数比分别为2∶1、1∶1的两种液态化合物X和Y,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种化合物F,其组成原子数之比为5∶1∶1∶3。
请回答下列问题:
(1)C原子在周期表的位置为___________;写出化合物EDA的电子式________。
(2)C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐,写出其化学式________;
(3)F溶液与足量EDA的稀溶液混合加热,其离子方程式为_____________________。
(4)氯气与C的简单气态氢化物相遇有白烟及C2生成,写出反应方程式_____________。
(5)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ·mol-1
N2O4(g) ΔH=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:___________________。
【答案】 第二周期第VA族 ![]() NH4NO3 HCO3—+NH4++2OH-
NH4NO3 HCO3—+NH4++2OH-![]() CO32-+2H2O+NH3↑ 8NH3+3Cl2
CO32-+2H2O+NH3↑ 8NH3+3Cl2![]() N2+6NH4Cl CH4(g)+N2O4(g)
N2+6NH4Cl CH4(g)+N2O4(g)![]() N2(g)+2H2O(l)+CO2(g) ΔH=-898.1 kJ·mol—1
N2(g)+2H2O(l)+CO2(g) ΔH=-898.1 kJ·mol—1
【解析】短周期元素A、B、C、D、E的原子序数依次增大。①C的简单气态氢化物遇湿润的红色石蕊试纸变蓝色,为氨气,则C为N元素;②A与D可以形成原子个数比分别为2∶1、1∶1的两种液态化合物X和Y,分别为水和过氧化氢,则A为H元素,D为O元素;A、E同主族,则E为Na元素,C与B、D相邻,则B为C元素;③A、B、C、D四种元素组成一种化合物F,其组成原子数之比为5∶1∶1∶3,F为NH4HCO3。
(1)C为N元素,在周期表中位于第二周期第VA族;化合物EDA为NaOH,属于离子化合物,电子式为![]() ;(2)硝酸与氨气化合生成NH4NO3;(3)F为NH4HCO3,与足量NaOH的稀溶液混合加热,离子方程式为HCO3-+NH4++2OH-
;(2)硝酸与氨气化合生成NH4NO3;(3)F为NH4HCO3,与足量NaOH的稀溶液混合加热,离子方程式为HCO3-+NH4++2OH-![]() CO32-+2H2O+NH3↑;(4)氯气与氨气相遇有白烟——氯化铵及N2生成,反应方程式为8NH3+3Cl2=N2+6NH4Cl;(5)已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1,②2NO2(g)=N2O4(g) ΔH=-56.9 kJ·mol-1,根据盖斯定律,将①-②得:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g) ΔH=(-955 kJ·mol-1)-(-56.9 kJ·mol-1)=-898.1 kJ·mol-1。
CO32-+2H2O+NH3↑;(4)氯气与氨气相遇有白烟——氯化铵及N2生成,反应方程式为8NH3+3Cl2=N2+6NH4Cl;(5)已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1,②2NO2(g)=N2O4(g) ΔH=-56.9 kJ·mol-1,根据盖斯定律,将①-②得:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g) ΔH=(-955 kJ·mol-1)-(-56.9 kJ·mol-1)=-898.1 kJ·mol-1。