题目内容
【题目】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0.
Fe(s)+CO2(g)△H>0.
已知在1100°C时,该反应的化学平衡常数K=0.263.
①温度升高,平衡移动后达到新平衡,此时平衡常数值________(填“增大”“减小”“不变”);
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向__________进行(填“左”或“右”).
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
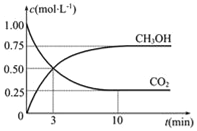
①反应开始至平衡,氢气的平均反应速率v(H2)=__________,CO2的转化率为_______.
该温度下上述反应的平衡常数K=____________(分数表示).
②反应达到平衡后,下列能使![]() 的值增大的措施是_________(填符号)。
的值增大的措施是_________(填符号)。
a.升高温度 b.再充入H2 c.再充入CO2
d.将H2O(g)从体系中分离 e.充入He(g)
③以8g甲醇为燃料,足量O2为氧化剂,250ml 浓度为1mol/L的KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).写出燃料电池负极的电极反应式:_________________。
④有人提出,可以设计反应2CO(g)=2C(s)+O2(g)(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由__________________________。
【答案】 增大 右 0.225 mol·(L·min)—1 75% ![]() L2/mol2 bd CH3OH ﹣6e— + 7OH— = HCO3—+ 5H2O 不能,因为该反应的△H>0,△S<O △H-T△S>0,不能自发进行
L2/mol2 bd CH3OH ﹣6e— + 7OH— = HCO3—+ 5H2O 不能,因为该反应的△H>0,△S<O △H-T△S>0,不能自发进行
【解析】(1)①由于该反应的正反应是吸热反应,所以温度升高,化学平衡正向移动,达到新的平衡时平衡常数K值增大;②1 100 ℃时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则浓度熵Q= c(CO2)÷c(CO)=0.025 mol·L-1÷0.1 mol·L-1=0.25<0.263=K,所以在这种情况下,该反应向正反应方向移动;(2)①根据图像可知:从反应开始到平衡,V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),V(H2)=3V(CO2)= 0.225mol/(L·min);CO2的转化率为0.75/1.00×100%=75%;平衡时氢气、二氧化碳、甲醇和水蒸气的物质的量浓度分别是0.75mol/L、0.25mol/L、0.75mol/L、0.75mol/L,所以该温度下上述反应的平衡常数K=![]() ;②a.升高温度,平衡逆向移动,
;②a.升高温度,平衡逆向移动, ![]() 减小,a错误;b.再充入H2使平衡正向移动,
减小,a错误;b.再充入H2使平衡正向移动, ![]() 增大,b正确;c.再充入CO2 平衡正向移动,但是Δc(CO2) 大于Δc(CH3OH), 比值减小,c错误;d.将H2O(g)从体系中分离,平衡正向移动,比值增大,d正确;E.充入He(g),平衡不移动,比值不改变,e错误,答案选bd。③8g甲醇为0.25mol,KOH是0.25mol,所以甲醇失去电子生成的CO2与氢氧化钾反应生成碳酸氢钾,因此该燃料电池负极的电极反应式为CH3OH-6e- + 7OH- = HCO3-+ 5H2O。④由于该反应的△H>0,△S<O,△H-T△S>0,所以不能自发进行。
增大,b正确;c.再充入CO2 平衡正向移动,但是Δc(CO2) 大于Δc(CH3OH), 比值减小,c错误;d.将H2O(g)从体系中分离,平衡正向移动,比值增大,d正确;E.充入He(g),平衡不移动,比值不改变,e错误,答案选bd。③8g甲醇为0.25mol,KOH是0.25mol,所以甲醇失去电子生成的CO2与氢氧化钾反应生成碳酸氢钾,因此该燃料电池负极的电极反应式为CH3OH-6e- + 7OH- = HCO3-+ 5H2O。④由于该反应的△H>0,△S<O,△H-T△S>0,所以不能自发进行。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)
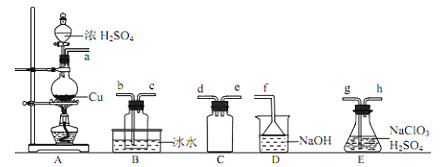
①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
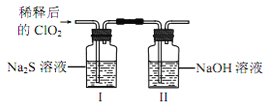
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。