题目内容
【题目】工业上以铬铁矿(含有Cr2O3,FeO、Al2O3、SiO2等成分)为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O),其主要工艺流程如下:

提示:熟料中含有Na2CrO4、NaFeO2等成分。
回答下列问题:
(1)将铬铁矿粉碎的目的是_____________________________ 。
(2)氧化焙烧时,生成Na2CrO4的化学方程式是__________。
(3)滤渣2中除Al(OH)3外还有__________(填化学式)。
(4)加入硫酸酸化的目的是__________________________。
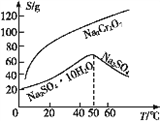
(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。
(6)控制105~110℃,向较浓的Na2Cr2O7溶液中加入KCl固体发生复分解反应,立即析出K2Cr2O7晶体。能生成K2Cr2O7晶体的原因是_____________。
(7)向Na2Cr2O7酸性溶液中加入过量FeSO4溶液,生成Cr3+和 Fe3+,再加入过量的强碱溶液生成铁铬氧体沉淀(CrxFe3-xO4)。加入过量强碱生成铁铬氧体沉淀的离子方程式是______。
【答案】 增大反应物的接触面,加快反应速率,提高原料的利用率。 2Cr2O3 + 3O2 + 8NaOH![]() 4Na2CrO4 + 4H2O H2SiO3 将Na2CrO4转化为Na2Cr2O7。 蒸发浓缩,趁热过滤 该温度下,KCl、Na2Cr2O7、K2Cr2O7、NaCl四种物质中K2Cr2O7溶解度最小。 xCr3+ + Fe2+ + (2-x) Fe3+ +8OH-
4Na2CrO4 + 4H2O H2SiO3 将Na2CrO4转化为Na2Cr2O7。 蒸发浓缩,趁热过滤 该温度下,KCl、Na2Cr2O7、K2Cr2O7、NaCl四种物质中K2Cr2O7溶解度最小。 xCr3+ + Fe2+ + (2-x) Fe3+ +8OH-![]() CrxFe3-xO4↓+ 4H2O
CrxFe3-xO4↓+ 4H2O
【解析】试题分析:(1)将铬铁矿粉碎可以增大反应物的接触面,加快反应速率,提高原料的利用率;(2)氧化焙烧时Cr2O3被氧气氧化为Na2CrO4;(3)矿石中SiO2焙烧生成硅酸钠,加入硫酸生成硅酸;(4)Na2CrO4在酸性条件下生成Na2Cr2O7;(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。(6)相同温度下,KCl、Na2Cr2O7、K2Cr2O7、NaCl四种物质中K2Cr2O7溶解度最小,析出K2Cr2O7沉淀;(7)加入过量强碱生成铁铬氧体沉淀,根据元素守恒;电荷守恒配平离子方程式。
解析:(1)将铬铁矿粉碎的目的是增大反应物的接触面,加快反应速率,提高原料的利用率;(2)氧化焙烧时Cr2O3被氧气氧化为Na2CrO4,反应方程式为2Cr2O3 + 3O2 + 8NaOH![]() 4Na2CrO4 + 4H2O ;(3)矿石中SiO2焙烧生成硅酸钠,加入硫酸生成硅酸,所以滤渣2中除Al(OH)3外还有H2SiO3沉淀;(4)Na2CrO4在酸性条件下能生成Na2Cr2O7,加入硫酸酸化的目的是将Na2CrO4转化为Na2Cr2O7;(5)根据硫酸钠在高温条件下溶解度比重铬酸钠小很多,所以混合溶液中析出硫酸钠晶体,步骤是蒸发浓缩,趁热过滤,洗涤,干燥。(6)相同温度下,KCl、Na2Cr2O7、K2Cr2O7、NaCl四种物质中K2Cr2O7溶解度最小,所以能生成K2Cr2O7晶体;(7)根据元素守恒;电荷守恒配平离子方程式得xCr3+ + Fe2+ + (2-x) Fe3+ +8OH-
4Na2CrO4 + 4H2O ;(3)矿石中SiO2焙烧生成硅酸钠,加入硫酸生成硅酸,所以滤渣2中除Al(OH)3外还有H2SiO3沉淀;(4)Na2CrO4在酸性条件下能生成Na2Cr2O7,加入硫酸酸化的目的是将Na2CrO4转化为Na2Cr2O7;(5)根据硫酸钠在高温条件下溶解度比重铬酸钠小很多,所以混合溶液中析出硫酸钠晶体,步骤是蒸发浓缩,趁热过滤,洗涤,干燥。(6)相同温度下,KCl、Na2Cr2O7、K2Cr2O7、NaCl四种物质中K2Cr2O7溶解度最小,所以能生成K2Cr2O7晶体;(7)根据元素守恒;电荷守恒配平离子方程式得xCr3+ + Fe2+ + (2-x) Fe3+ +8OH-![]() CrxFe3-xO4↓+ 4H2O。
CrxFe3-xO4↓+ 4H2O。