��Ŀ����
����Ŀ�������£���0.100mol��L-1NaOH��Һ�ֱ�ζ�20.00mL0.100mol��L-1������ʹ��ᣬ�ζ�������ͼ�������Ƿ�Ӧ����ЧӦ������˵����ȷ����

A. ���ߢ��ʾ���ǵζ����������
B. �ζ���������У���Һ�� ����
����
C. V(NaOH)=10.00mLʱ��������Һ��c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. V(NaOH)=20.00mLʱ��������Һ��c(Cl-)>c(CH3COO-)
���𰸡�D
��������A�����ߢ��ʾ���ǵζ���������ߣ�������������ʣ�ͻ�䷶ΧС����A����B���ζ���������У���Һ��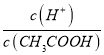 =
=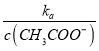 ���¶Ȳ��䣬Ka�Ƕ�ֵ��
���¶Ȳ��䣬Ka�Ƕ�ֵ�� ![]() ���
��� 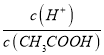 =
=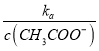 ��С����B����C�� V(NaOH)=10.00mLʱ����Һ�൱���ǵ�Ũ�ȴ���ʹ����ƵĻ�������������ˮ�⣬������Һ��c(CH3COO-)>c(Na+)>c(H+)>c(OH-)����C����D��V(NaOH)=20.00mLʱ��������Һ��NaCl��CH3COONa��ȣ�CH3COONa����ˮ�⣬c(Cl-)>c(CH3COO-)����D��ȷ����ѡD��
��С����B����C�� V(NaOH)=10.00mLʱ����Һ�൱���ǵ�Ũ�ȴ���ʹ����ƵĻ�������������ˮ�⣬������Һ��c(CH3COO-)>c(Na+)>c(H+)>c(OH-)����C����D��V(NaOH)=20.00mLʱ��������Һ��NaCl��CH3COONa��ȣ�CH3COONa����ˮ�⣬c(Cl-)>c(CH3COO-)����D��ȷ����ѡD��

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д�����Ŀ���������ȣ�ClO2���Ǽ�������ˮ�Ҳ���ˮ������ѧ��Ӧ�Ļ���ɫ���壬�е�Ϊ11�棬�����ڴ��������ˮ��ijС����ʵ������̽��ClO2��Na2S�ķ�Ӧ���ش��������⣺
(l)ClO2���Ʊ�������֪��SO2+2NaClO3+H2SO4=2ClO2��+2NaHSO4��

��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ_______________��
�����ռ������ClO2��ѡ����ͼ�е�װ�ã�������˳��Ϊ a��_________(������������Сд��ĸ��ʾ)
��װ��D��������_________��
��2��ClO2�� Na2S �ķ�Ӧ
�������ռ�����ClO2�� N2ϡ������ǿ���ȶ��ԣ�����������ϡ�ͺ��ClO2ͨ����ͼ��ʾװ���г�ַ�Ӧ���õ���ɫ������Һ��һ��ʱ���ͨ������ʵ��̽�� I �з�Ӧ�IJ��

�������� | ʵ������ | ���� |
ȡ����������Һ���Թܼ��У� ����Ba(OH)2��Һ���� | ��_________ | ��������������� |
��ȡ����������Һ���Թ����У� �μ�Ʒ����Һ������ | Ʒ����Һ����ɫ | �� ��_____���� |
�����Թܼ��м�����Ba(OH)2��Һ�� ���������ã�ȡ�ϲ���Һ���Թܱ���______ | �а�ɫ�������� | ��Cl-���� |
��ClO2��Na2S��Ӧ�����ӷ���ʽΪ__________�����ڴ��������ˮʱ��ClO2�����Cl2���ŵ���____________(��д2��)��