题目内容
19.以下是关于化学反应2SO2+O2?2SO3的两个素材:素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量
| 时间(s)物质的量(mol)物质 | 0 | 10 | 20 | 30 | 40 | 0 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075mol•L-1•s-1.
(2)根据素材2中分析得到,提高该化学反应限度的途径有增大压强或在一定范围内降低温度.
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是温度为600℃,压强为1MPa.
分析 (1)根据20-30s内二氧化硫的物质的量的变化及v=$\frac{△c}{△t}$来计算;
(2)根据素材2可知,压强越大、温度越低时有利于提高该化学反应限度;
(3)根据素材1计算二氧化硫的转化率,利用素材2来确定合适的温度、压强.
解答 解:(1)由素材1可知,20-30s内二氧化硫的物质的量的变化量为0.5mol-0.35mol=0.15mol,
则二氧化硫表示的化学反应的平均速率为$\frac{\frac{0.15mol}{2L}}{10s}$=0.0075 mol•L-1•s-1,
故答案为:0.0075 mol•L-1•s-1;
(2)由素材2可知,压强越大、温度越低时有利于提高该化学反应限度,但温度太低时反应速率较慢,
故答案为;增大压强或在一定范围内降低温度;
(3)由素材1可知,50s时反应达到平衡,则二氧化硫的转化率为$\frac{1mol-0.1mol}{1mol}$=90%,
结合素材2可知,转化率为90%时温度为600℃,压强为1MPa,
故答案为:温度为600℃,压强为1MPa.
点评 本题考查化学平衡的影响,为高频考点,本题考查的侧重点为表格、数据的分析,有利于培养学生良好的科学素养和思维能力,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.化学与人类生活密切相关,对下列生活中的现象的解释不正确的是( )
| A. | “地沟油”危害健康,是因为脂肪酸油脂中的碳碳双键被破坏,不利健康 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土可用作水果保鲜制是因为高锰酸钾溶液可吸收水果释放的乙烯 | |
| C. | 废旧电池必须回收利用,是因为电池中的重金属等会严重污染土壤和水体 | |
| D. | 食品包装袋、食物保鲜膜通常用聚乙烯树脂,是因为聚乙烯树脂是无毒的高分子化合物 |
14.下列实验现象中,由于发生取代反应而引起的是( )
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 苯滴加到溴水中,振荡后水层接近无色 | |
| C. | 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 | |
| D. | 甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
4.下列关于常见化学物质的应用不正确的是( )
| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
8.已知AgCl的溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),下列说法不正确的是( )
| A. | 除去溶液中Ag+加盐酸盐比硫酸盐好 | |
| B. | 加入H20,溶解平衡不移动 | |
| C. | 用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 | |
| D. | 反应2AgCl+Na2S═Ag2S+2NaCl 说明溶解度:AgCl>Ag2S |
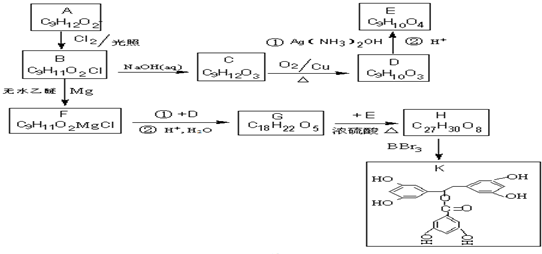
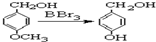
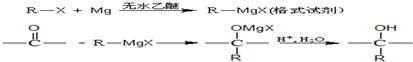
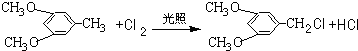 .
. ;
;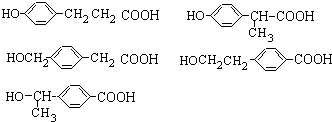 (任意3个);.
(任意3个);.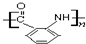 .(无机试剂任选.用流程图表示:写出反应物、产物及主要反应条件).
.(无机试剂任选.用流程图表示:写出反应物、产物及主要反应条件).
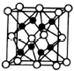 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题: