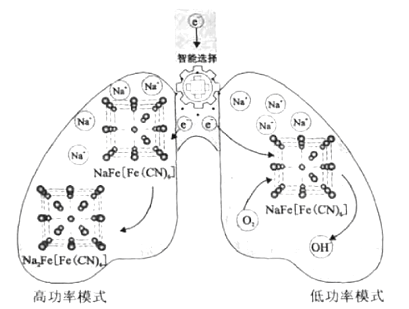
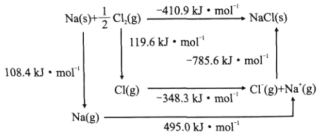
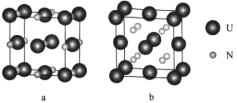
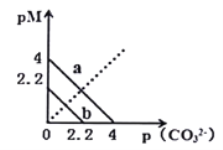
题目内容
【题目】用两支惰性电极插入50mLAgNO3溶液中,通电电解。当电解液的PH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是:
A. 27mg B. 54mg C. 108mg D. 216mg
【答案】B
【解析】
根据题意可知氢离子浓度的变化量是(10-3-10-6)mol/L=10-3mol/L,所以反应中生成的氢离子的物质的量是0.5L×1010-3mol/L=5×10-4mol。惰性电极电解硝酸银的反应式为4AgNO3+2H2O![]() 4HNO3+4Ag+O2↑,所以析出的银也是5×10-4mol,其质量是5×10-4mol×108g/mol=0.054g=54mg,答案选B。
4HNO3+4Ag+O2↑,所以析出的银也是5×10-4mol,其质量是5×10-4mol×108g/mol=0.054g=54mg,答案选B。

练习册系列答案
相关题目