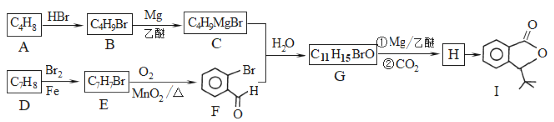
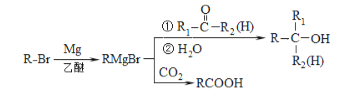
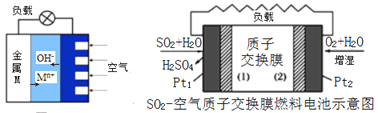
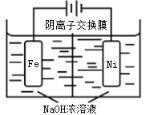
题目内容
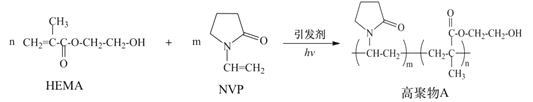
【题目】将标准状况下2.24L CO2缓慢通入1L 0.15mol·L-1的NaOH溶液中,气体被充分吸收(溶液体积变化忽略不计),下列关系式不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
【答案】C
【解析】
n(CO2)=2.24L/22.4L·mol-1=0.1mol,n(NaOH)=1L×0.15mol·L-1=0.15mol,则发生:2CO2+3OH-=CO32-+HCO3-+H2O,结合CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-解析。
H2CO3+OH-解析。
n(CO2)=2.24L/22.4L·mol-1=0.1mol,n(NaOH)=1L×0.15mol·L-1=0.15mol,则发生:2CO2+3OH-=CO32-+HCO3-+H2O,结合①CO32-+H2O![]() HCO3-+OH-,②HCO3-+H2O
HCO3-+OH-,②HCO3-+H2O![]() H2CO3+OH-,则有:
H2CO3+OH-,则有:
A、溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A正确。
B、n(CO32-)+n(HCO3-)+n(H2CO3)=0.1mol,n(Na+)=0.15mol,根据物料守恒得,2C(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)],故B正确。
C、n(CO32-)+n(HCO3-)+n(H2CO3)=0.1mol,n(Na+)=0.15mol,又存在①CO32-+H2O![]() HCO3-+OH-,②HCO3-+H2O
HCO3-+OH-,②HCO3-+H2O![]() H2CO3+OH-,水解程度①>②且水解程度都较小,则c(HCO3-)>c(CO32-)>c(OH-),则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误。
H2CO3+OH-,水解程度①>②且水解程度都较小,则c(HCO3-)>c(CO32-)>c(OH-),则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误。
D、根据阴阳离子所带电荷相等得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①,根据物料守恒得2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]②,将方程式②-①×2得2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确。
故选C。

【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为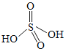 ,则
,则![]() 的结构式为_________。
的结构式为_________。
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:
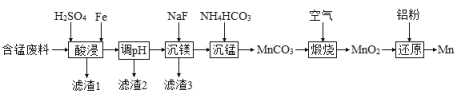
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
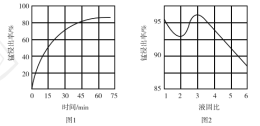
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜(Cu)、硒(Se)、碲(Te)外,还含有少量稀贵金属,主要物质为Cu、Cu2Se和Cu2Te。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数(%) | 0.04 | 0.76 | 0.83 | 43.47 | 17.34 | 9.23 |
(1)16S、34Se、52Te为同主族元素,其中34Se在元素周期表中的位置______。
其中铜、硒、碲的主要回收流程如下:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:Cu2Te+____H2SO4 ![]() 2CuSO4+____TeO2+____+____H2O
2CuSO4+____TeO2+____+____H2O
(3)SeO2与吸收塔中的H2O反应生成亚硒酸。焙烧产生的SO2气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为______ 。
(4)沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。
① “水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因__________。
②滤液2经过、____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
(5)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着TeO32-浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为___________________。