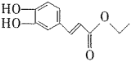
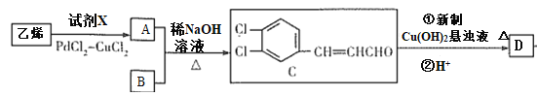
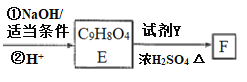
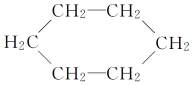题目内容
【题目】某有机物完全燃烧生成CO2和H2O。将12.4 g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重10.8 g,再通过碱石灰,碱石灰增重了17.6 g。下列说法不正确的是
A. 该有机物的最简式为CH3O
B. 该有机物的分子式可能为CH3O
C. 该有机物的分子式一定为C2H6O2
D. 该有机物可能属于醇类
【答案】B
【解析】
浓硫酸增重的为水的质量,碱石灰增重的为二氧化碳的质量,根据n=![]() 计算出水、二氧化碳的物质的量,再根据质量守恒确定含有氧元素的质量及物质的量;根据C、H、O元素的物质的量之比得出该有机物达到最简式,根据有机物结构与性质及核磁共振氢谱的知识对各选项进行判断。
计算出水、二氧化碳的物质的量,再根据质量守恒确定含有氧元素的质量及物质的量;根据C、H、O元素的物质的量之比得出该有机物达到最简式,根据有机物结构与性质及核磁共振氢谱的知识对各选项进行判断。
将12.4 g该有机物的完全燃烧产物通过浓硫酸,浓硫酸起干燥剂作用,其增重的10.8 g为水的质量,则水的物质的量为:![]() = 0.6 mol,含有H元素的物质的量为:0.6 mol×2=1.2 mol,其H质量为:1 g/mol×1.2 mol=1.2 g,
= 0.6 mol,含有H元素的物质的量为:0.6 mol×2=1.2 mol,其H质量为:1 g/mol×1.2 mol=1.2 g,
碱石灰吸收二氧化碳,则碱石灰增重的17.6g为二氧化碳的质量,其CO2物质的量为:![]() = 0.4 mol,原有机物中含有C的质量为:12g/mol×0.4mol = 4.8 g,
= 0.4 mol,原有机物中含有C的质量为:12g/mol×0.4mol = 4.8 g,
故该有机物中含有C、H元素的质量为:4.8g+1.2g = 6 g< 12.4g,所以该有机物分子中含有氧元素,含有氧元素的物质的量为:12.4g![]() = 0.4 mol,
= 0.4 mol,
所以该有机物分子中C、H、O原子数之比为:0.4mol:1.2mol:0.4mol=1:3:1,其最简式为:CH3O,
A. 根据分析可知,该有机物的最简式为CH3O,故A项正确;
B. 该有机物分子中只含有C、H、O三种元素,H原子数只能为偶数,其分子式不可能为CH3O,故B项错误;
C. 设该有机物分子式为(CH3O)n,当n=2时,得到的分子式C2H6O2中H原子已经达到饱和,则该有机物的分子式为C2H6O2,故C项正确;
D.乙二醇属于醇类,其分子式为C2H6O2,则该有机物可能属于醇类,故D项正确;
答案选B。