题目内容
【题目】NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 常温常压下,31 g P4中含P-P键的数目为NA
B. 常温常压下,46 g NO2与92 g N2O4所含的分子数相同
C. 一定条件下,6.4 g铜粉与过量的硫粉充分反应,转移电子数为0.2 NA
D. 标准状况下,将22.4 L Cl2 通入足量NaOH溶液中,转移电子数为NA
【答案】D
【解析】
A.每个P4中含6个P-P键,31 gP4的物质的量为![]() =0.25mol,则31 g P4中含P-P键的数目为1.5NA,故A错误;
=0.25mol,则31 g P4中含P-P键的数目为1.5NA,故A错误;
B.常温常压下,存在2NO2![]() N2O4,则1molNO2与1molN2O4所含的分子数不相同,故B错误;
N2O4,则1molNO2与1molN2O4所含的分子数不相同,故B错误;
C.Cu和S在加热条件下生成Cu2S,则6.4g铜粉与过量的硫粉充分反应,转移电子数为0.1NA,故C错误;
D.标准状况下,22.4LCl2的物质的量为0.1mol,其完全溶于足量NaOH溶液中生成NaCl和NaClO,转移电子数为NA,故D正确;答案为D。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
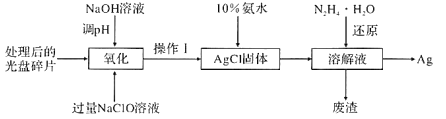
一线名师口算应用题天天练一本全系列答案【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为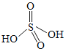 ,则
,则![]() 的结构式为_________。
的结构式为_________。
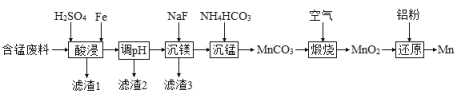
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
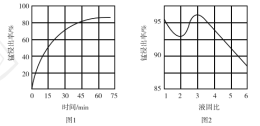
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。