题目内容
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:
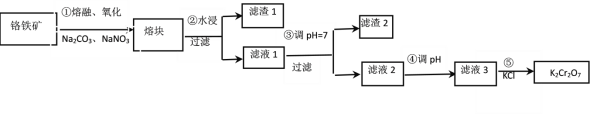
已知:a.步骤①的主要反应为:2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+ ![]() Cr2O72-+H2O,下列说法正确的是
Cr2O72-+H2O,下列说法正确的是
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8L CO2共转移7mol电子
C. 步骤④若调节滤液2的pH使之变小,则有利于生成Cr2O72—
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7
【答案】CD
【解析】
A.陶瓷含有二氧化硅,SiO2+Na2CO3![]() Na2SiO3+CO2↑,陶瓷容器会被腐蚀,故A错误;
Na2SiO3+CO2↑,陶瓷容器会被腐蚀,故A错误;
B.步骤①中发生的反应中存在2CO2~7e-关系,每生成44.8L(标况下)即2molCO2共转移7mol电子,题中没有给定标况下,44.8L CO2物质的量不一定为2mol,故B错误;
C.步骤④若调节滤液2的pH使之变小,增大氢离子浓度,上述可逆反应的平衡右移,则有利于生成Cr2O72-,故C正确;
D.在溶液中溶解度较小的晶体容易先析出,步骤⑤中生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7,故D正确。
综上所述,本题选CD。

【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
![]()
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有误的是(填编号)____,若测定结果偏高,其原因可能是______.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是____________________________。
(3)如下图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |