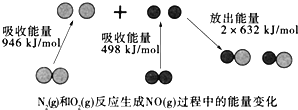
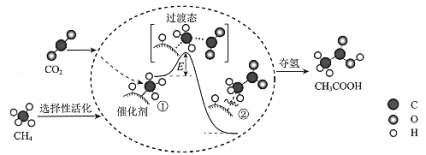
题目内容
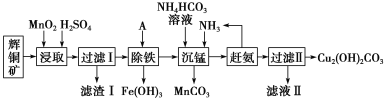
【题目】铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
【答案】MnO2 S SiO2 CuO 或 Cu(OH)2 或CuCO3或Cu2(OH)2CO3 4.0×10-8 Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O (NH4)2SO4 取少量最后一次洗涤液于试管中,加入足量稀HCl酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净
【解析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液pH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜。
(1)由滤渣1的成份可知反应的化学方程式是:
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
(2)根据Ksp[Fe(OH)3]=c(Fe3+)[c(OH-)]3=4.0×10-38,根据OH-离子的浓度计算Fe3+离子的浓度;
(3)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
(4)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体;
(5)根据硫酸根离子的检验方法进行分析。
(1)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,故答案为:MnO2,S、SiO2。
(2)加入的试剂A应用于调节溶液pH,促进铁离子的水解,但不能引入杂质,因最后要制备碱式碳酸铜,则可加入CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等,若加入A后溶液的pH值为4,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38,则溶液中铁离子浓度:4.0×10-38/(10-10)3mol/L=4.0×10-8mol/L,故答案为:4.0×10-8。
(3)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O,故答案为:Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O。
(4)滤液Ⅱ主要是硫酸铵溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4。
(5)分析流程题可知,第一步加入了H2SO4,在整个过程中没有除去H2SO4,判断沉淀是否已经洗净,就是检验是否含有SO42-,检验方法为:取少量最后一次洗涤液于试管中,加入足量稀HCl酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,故答案为:取少量最后一次洗涤液于试管中,加入足量稀HCl酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净。