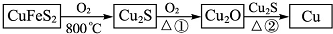题目内容
13.将质量为1g,相同大小的两块铜片分别投入到足量的浓硝酸和稀硝酸中,下列有关说法正确的是( )| A. | 反应后的溶液的质量相同 | B. | 与浓硝酸的反应中,铜片先消失 | ||
| C. | 产生气体的颜色相同 | D. | 产生气体的体积相同(相同条件) |
分析 A、根据反应方程式消耗铜和生成气体质量变化分析;
B、反应速率与溶液的浓度有关,浓度越高,反应速率越快;
C、二氧化氮是红棕色气体,一氧化氮是无色气体,根据生成气体的颜色判断;
D、根据反应方程式中定量关系计算判断.
解答 解:A、由Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O,Cu+$\frac{8}{3}$HNO3=Cu(NO3)2+$\frac{2}{3}$NO↑+$\frac{4}{3}$H2O,原足量的浓硝酸和稀硝酸的溶液质量不知,不能判断溶液质量变化,故A错误;
B、因为溶液浓度影响化学反应速率,浓度越大,反应速率越快,所以浓硝酸比稀硝酸反应速率快,与浓硝酸的反应中,铜片先消失,故B正确;
C、根据B知,铜与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,二氧化氮是红棕色气体,一氧化氮是无色气体,故C错误;
D、根据铜与转移电子的关系知,
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O
1mol 2mol
Cu+$\frac{8}{3}$HNO3=Cu(NO3)2+$\frac{2}{3}$NO↑+$\frac{4}{3}$H2O
1mol $\frac{2}{3}$mol
根据方程式知,相同质量的铜与过量浓、稀硝酸反应生成气体体积不同,故D错误;
故选B.
点评 本题考查了铜与浓、稀硝酸的反应,难度中等,能正确书写铜与浓、稀硝酸反应的方程式是解本题的关键.

练习册系列答案
相关题目
4.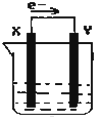 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )| A. | 外电路电流方向为:X→外电路→Y | |
| B. | 若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两极都是金属,则它们的活动顺序为X>Y |
8.已知某金属元素R的+1价阳离子最外层有2个电子,该阳离子有6个电子层下列推断正确的是( )
| A. | R元素位于第6周期,ⅢB族 | B. | R(OH)3与Al (OH)3一样是两性氢氧化物 | ||
| C. | R单质还原性比铝强 | D. | 离子半径:R3+>R+ |
5.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 乙烯能发生加成反应而乙烷不能 | |
| B. | 苯酚(C6H5OH)能跟NaOH溶液反应而乙醇不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
2.下列化学用语表示正确的是( )
| A. | 氮气的电子式  | |
| B. | Mg2+的结构示意图  | |
| C. | NH3的结构式 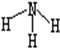 | |
| D. | 用电子式表示溴化氢的形成过程为: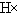 + +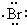 → →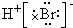 |
16.下列说法错误的是( )


| A. | 对于A(s)+2B(g)?3C(g)△H>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示则Y可能表示温度,x可能表示压强,且Y3>Y2>Y1 | |
| B. | 已知可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 | |
| C. | 已知反应2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),满足如图③所示的关系,则B、C可能均为气体 | |
| D. | 图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应 |