题目内容
6.下列各组中化合物的性质比较,不正确的是( )| A. | 酸性:HClO4>HBrO4>HIO4 | B. | P、S、C1元素最高正价依次升高 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 离子半径:Mg2+<Na+<F- |
分析 A、元素的非金属性越强最高价氧化物对应水化物的酸性越强;
B、最高正价等于最外层电子数;
C、元素的非金属性越强,对应的氢化物越稳定;
D、电子层结构相同核电荷数越大离子半径越小;
解答 解:A、Cl、Br、I位于同一主族,同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱,故A正确;
B、P、S、C1元素最外层电子数分别是5、6、7,所以最高正价依次升高,故B正确;
C、元素的非金属性:P<S<C1,对应的氢化物越稳定:PH3<H2S<HCl,故C错误;
D、电子层结构相同核电荷数越大离子半径越小,故离子半径F->Na+>Mg2+,故D正确;
故选C.
点评 本题考查元素周期律知识,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
16.在元素周期表中第三周期所含元素的种数为( )
| A. | 2 | B. | 8 | C. | 18 | D. | 32 |
1.下列物质中,只含有离子键,不含有共价键的是( )
| A. | CaCl2 | B. | KOH | C. | HCl | D. | NH4 NO3 |
11.常温常压下,下列各组物质的物理性质排列不正确的是( )
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
18.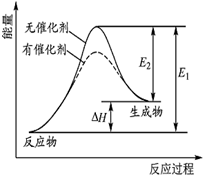 某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
 某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变 | |
| C. | 催化剂不能降低反应的活化能 | |
| D. | 逆反应的活化能小于正反应的活化能 |
15.已知元素砷(As)的原子序数为33,与N元素同主族,下列叙述正确的是( )
| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
16.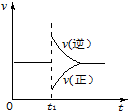 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )| A. | t1时改变某一条件,平衡将向逆反应方向移动 | |
| B. | 维持压强不变,t1时升高反应体系温度 | |
| C. | 维持温度不变,t1时扩大反应体系体积 | |
| D. | 维持温度、压强不变,t1时充入SO2(g) |

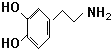
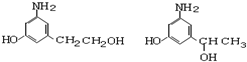 .
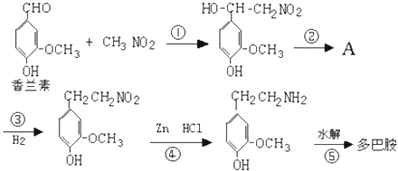
.
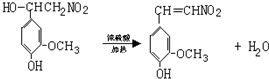 .
.