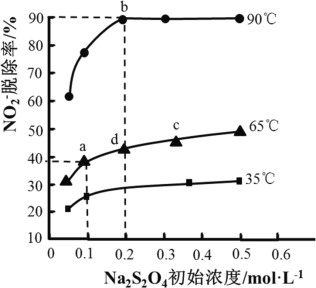
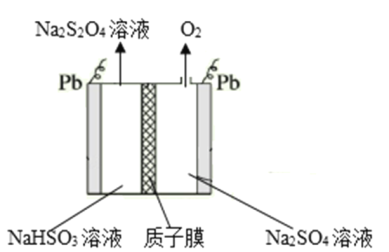
题目内容
【题目】有关电化学示意图如下。回答下列问题:
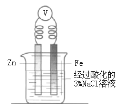
(1)图中正极的电极反应是______;当Zn片的质量减少0.65g时,外电路中有_____mol电子通过。

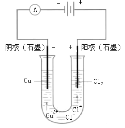
(2)预测图中U型管的实验现象是______;结合化学用语解释产生现象的原因____。

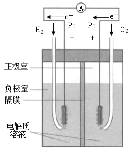
(3)用石墨电极电解滴加紫色石蕊溶液的稀Na2SO4溶液,通电后A、B两极均有无色气体生成,装置如图所示:

①NaOH在______极生成(填“A”或“B”)。
②B极发生反应的类型为______反应(填“氧化”或“还原”)。
【答案】Cu2++2e-=Cu 0.02 左边液面上升,右边液面下降 试管中的铁钉发生吸氧腐蚀,正极反应为O2+2H2O+4e-=4OH-,O2减少而使试管中的压强小于大气压 A 氧化
【解析】
结合原电池原理分析电极反应,并计算转移电子的物质的量;根据金属的吸氧腐蚀分析;根据电解原理分析电解产物。
(1)图中Zn为负极,发生的电极反应为Zn-2e-=Zn2+,Cu为正极,发生的电极反应为Cu2++2e-=Cu,0.65g Zn的物质的量为![]() =0.01mol,则外电路中有0.02mol电子通过;
=0.01mol,则外电路中有0.02mol电子通过;
(2)铁钉发生吸氧腐蚀,正极反应式为O2+4e-+2H2O=4OH-,则试管中O2减少而使试管中的压强小于大气压,导致U型管内左边液面上升,右边液面下降;
(3)A为电解池的阴极,发生电极反应为2H++2e-=H2↑,B为阳极,发生电极反应为4OH-4e-=O2↑+2H2O;
①A极H+被还原生成H2,促进水的电离,A极周围OH-增大,则NaOH在A极生成;
②B极为阳极,发生反应的类型为氧化反应。

【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A | B | C | D | |
反应装置或图象 |
|
|
|
|
实验现象或图象信息 | 温度计的水银柱上升 | 反应物总能量大于生成物总能量 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲处液面低于乙处液面 |
A.AB.BC.CD.D
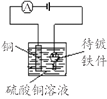
【题目】中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
原理 | 牺牲阳极的阴极保护法 | 电镀 | 电解CuCl2溶液 | 氢氧燃料电池 |
A.AB.BC.CD.D