��Ŀ����
����Ŀ����Чȥ��NO�ǻ����������ش���⡣�ش��������⣺
(1)NaClO2����ȥ��NO
��֪��5 NaClO2(aq)+4HCl(aq)��4ClO2(g)+2H2O(l)+5NaCl(aq) ��H1
5NO(g)+3ClO2(g)+4H2O(l)��5HNO3(aq)+3HCl(aq) ��H2
��Ӧ4NO(g)+3NaClO2(aq)+2H2O(l)��4HNO3(aq)+3NaCl(aq)
��H��_____(�ú���H1����H2�Ĵ���ʽ��ʾ)
(2)��������(Na2S2O8)����ȥ��NO
��һ����NO�ڼ��Ի����б�Na2S2O8����ΪNaNO2
�ڶ�����NaNO2����������ΪNaNO3����ӦΪNO2��+S2O82��+2OH��NO3��+2SO42��+H2O��
��ͬ�¶��£�ƽ��ʱNO2�����ѳ������������(Na2S2O8)��ʼŨ�ȵĹ�ϵ��ͼ��ʾ��

��ƽ��ʱb��d�����Ũ�ȣ�c(S2O82��)b_____c(S2O82��)d(������������������������)
��a��b��c����ƽ�ⳣ��K�ɴ�С��˳��Ϊ_____��ԭ����_____��
�۳����£���Ӧ��NO2����S2O82���ij�ʼŨ�Ⱦ�Ϊ x molL��1����Ӧ��ƽ��ʱ��ҺpH��14��NO3��Ũ��Ϊ y molL��1(���Է�Ӧǰ����Һ����ı仯)���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ_____��
(3)������������(Na2S2O4)��ԭȥ��NO������������������(Na2S2O4)��Һ��ԭNOȥ����Ⱦ���ٵ�����ɵ�NaHSO3��������Na2S2O4�����������ͼ��ʾ������Ĥ����H+��H2Oͨ���������ĵ缫��ӦʽΪ_____�������� n molNO�����Һ�����ǡ����ȫ����ʱ�����������ɵ�O2�ڱ�״���µ����Ϊ_____L��

���𰸡�![]() (3��H1+4��H2) �� K(b)��K(a)��K(c) ��ͼ��֪��ӦΪ���ȷ�Ӧ�����¶�����ƽ�ⳣ����������ΪT(b)��T(a)��T(c)����K(b)��K(a)��K(c)
(3��H1+4��H2) �� K(b)��K(a)��K(c) ��ͼ��֪��ӦΪ���ȷ�Ӧ�����¶�����ƽ�ⳣ����������ΪT(b)��T(a)��T(c)����K(b)��K(a)��K(c) ![]() 2HSO3��+2e��+2H+��S2O42��+2H2O 11.2n
2HSO3��+2e��+2H+��S2O42��+2H2O 11.2n
��������
(1)���ݸ�˹���ɽ��м��㣻
(2)����ͼ��֪����������(Na2S2O8)��ʼŨ����ͬ���¶����ߣ�NO2�����ѳ�������Ӧ�����ڷ�Ӧ������ƽ��ʱ��������(Na2S2O8)��С��
����ͼ��֪����������(Na2S2O8)��ʼŨ����ͬ���¶����ߣ�NO2�����ѳ������÷�ӦΪ���ȷ�Ӧ���¶�����ѧƽ�ⳣ������
�۳����£���Ӧ��NO2����S2O82���ij�ʼŨ�Ⱦ�Ϊ x molL��1��NO3��Ũ��Ϊ y molL��1����ôƽ��ʱ��NO2����S2O82����Ũ�Ⱦ�Ϊ(x��y)molL��1��SO42����Ũ��Ϊ2ymolL��1����Ӧ��ƽ��ʱ��ҺpH��14�����ʱOH����Ũ��Ϊ1mol/L������ƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȽ��м��㣻
(3)��������������(Na2S2O4)��Һ��ԭNOȥ����Ⱦ���ٵ�����ɵ� NaHSO3��������Na2S2O4�������õ����ӷ�����ԭ��Ӧ��ΪNaHSO3�ŵ磻n molNO�����Һ�����ǡ����ȫ����ʱ�����ɵ�����ת�Ƶ���Ϊ2nmol���ݴ˽��м��㡣
(1)��֪����5 NaClO2 (aq)+4HCl(aq)��4ClO2(g)+2H2O(l)+5NaCl(aq) ��H1
��5NO(g)+3ClO2(g)+4H2O(l)��5HNO3(aq)+3HClaq) ��H2
���ݸ�˹����![]() (3����+4����)�ɵã�4NO(g)+3NaClO2(aq)+2H2O(l)��4HNO3(aq)+3NaCl(aq) ��H��
(3����+4����)�ɵã�4NO(g)+3NaClO2(aq)+2H2O(l)��4HNO3(aq)+3NaCl(aq) ��H��![]() (3��H1+4��H2)��
(3��H1+4��H2)��
(2)����ͼ��֪����������(Na2S2O8)��ʼŨ����ͬ���¶����ߣ�NO2�����ѳ�������Ӧ�����ڷ�Ӧ�������¶����ߣ�ƽ��ʱ��������(Na2S2O8)��С�����c(S2O82��)b��c(S2O82��)d��
����ͼ��֪����������(Na2S2O8)��ʼŨ����ͬ���¶����ߣ�NO2�����ѳ�������˵���¶�����������������ӦΪ���ȷ�Ӧ�����¶�����ѧƽ�ⳣ����������ΪT(b)��T(a)��T(c)����K(b)��K(a)��K(c)��
�۳����£���Ӧ��NO2����S2O82���ij�ʼŨ�Ⱦ�Ϊ x molL��1��NO3����ƽ��Ũ��Ϊ y molL��1����ƽ��ʱ��NO2����S2O82����Ũ�Ⱦ�Ϊ(x��y)molL��1��SO42����Ũ��Ϊ2ymolL��1����Ӧ��ƽ��ʱ��ҺpH��14�����ʱOH����Ũ��Ϊ1mol/L���ʷ�Ӧ�Ļ�ѧƽ�ⳣ��K��![]() ��
��
(3)��������������(Na2S2O4)��Һ��ԭNOȥ����Ⱦ���ٵ�����ɵ� NaHSO3��������Na2S2O4�������õ����ӷ�����ԭ��Ӧ��ΪNaHSO3�ŵ磬��ӦΪ��2HSO3��+2e��

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�����Ŀ��һ���¶��£�10mL 0.40 mol��L-1H2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ� ������Һ����仯���Բ��ƣ�
A. ��Ӧ��6minʱ��H2O2�ֽ���50��
B. ��Ӧ��6minʱ��c(H2O2)=0.20 mol��L-1
C. 0~6min��ƽ����Ӧ���ʣ�v(H2O2)��3.3��10-2mol/(L��min)
D. 4~6min��ƽ����Ӧ���ʣ�v(H2O2)>3.3��10-2mol/(L��min)
����Ŀ������ʵ�鷽���У����ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | A | B | C | D |
ʵ�鷽�� |
|
|
|
|
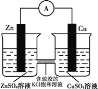
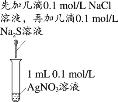
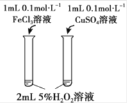
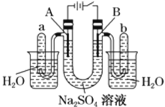
Ŀ�� | �о��¶ȶԻ�ѧƽ���Ӱ�� | ��֤п������ͭ��Ӧ�������е���ת�� | ֤���ܽ�ȣ�AgCl��Ag2S | �Ƚϲ�ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� |
A.AB.BC.CD.D