题目内容
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________,基态铁原子的价电子排布图为_______
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。

(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子__________(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。

(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。

【答案】哑铃形(纺锤形) N原子的2P轨道电子处半充满状态,比较稳定, ![]() sp3 制炸药(或高能燃料) CO2或N2O DE 1:2:4
sp3 制炸药(或高能燃料) CO2或N2O DE 1:2:4 ![]() Fe3C。
Fe3C。
【解析】
(1)N原子最高能级是2p能级;N原子的2P轨道电子处半充满状态,比较稳定;基态铁原子价电子排布式为3d64s2;
(2)氮原子价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,氮原子的杂化轨道类型为sp3;这种高聚氮N-N 键的键能为160kJ/mol,而N2的键能为942kJ/mol,其可能潜在的应用是制炸药(或高能燃料);
=4,氮原子的杂化轨道类型为sp3;这种高聚氮N-N 键的键能为160kJ/mol,而N2的键能为942kJ/mol,其可能潜在的应用是制炸药(或高能燃料);
(3)①N3-有3个原子和16个价电子,故与N3-属于等电子体的分子有CO2或N2O;
②氢叠氮酸(HN3) 可由肼(N2H4)被HNO2氧化制得,同时生成水。
(4)A含有1.5个亚铁离子、4个氯离子,B含有0.5个亚铁离子、4个氧离子、4个铁离
子;
晶胞含有Fe2+、Fe3+、O2-的个数分别是为4、8、16,它们的相对质量之和是8×232,根据m=![]() V计算;
V计算;
(5)根据均摊原则每个铁原子又为两个八面体共用,所以铁与碳原子数比是6![]() :1=3:1。
:1=3:1。
(1)N为7号元素,基态N 原子的核外电子排布式是1s22s22p3;最高能级2p能级的电子云轮廓图形状为哑铃形(纺锤形);N原子的2P轨道电子处半充满状态,比较稳定,故N原子的第一电离能比O原子的大;
Fe是26号元素,其原子核外有26个电子,其价电子排布式为3d64s2,故基态铁原子的价电子排布图为:![]() ;
;
故答案为:哑铃形(纺锤形);N原子的2P轨道电子处半充满状态,比较稳定;![]() ;
;
(2)每个氮原子最外层均满足8电子稳定结构,N原子的最外层有5个电子,可形成3个共价键,价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,氮原子的杂化轨道类型为sp3;这种高聚氮N-N 键的键能为160kJ/mol,而N2的键能为942kJ/mol,其可能潜在的应用是制炸药(或高能燃料);
=4,氮原子的杂化轨道类型为sp3;这种高聚氮N-N 键的键能为160kJ/mol,而N2的键能为942kJ/mol,其可能潜在的应用是制炸药(或高能燃料);
故答案为:sp3;制炸药(或高能燃料);
(3)①N3-有3个原子和16个价电子,故与N3-属于等电子体的分子有CO2或N2O;
②氢叠氮酸(HN3) 可由肼(N2H4)被HNO2氧化制得,同时生成水。
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2H2O,A正确;
B.钠离子的半径小于钾离子,故NaN3的晶格能大于KN3的晶格能,B正确;
C.氢叠氮酸(HN3)和水能形成分子间氢键,C正确;
D.HN3是极性分子,N2H4是非极性分子,D不正确;
E.HN3分子结构示意图为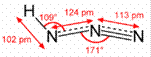 ,靠近H原子的第1个N原子是sp2杂化的,第二个N原子是sp杂化的,端位的N原子不杂化,故四个原子不在一条直线上,E不正确。综上所述,叙述错误的是DE 。
,靠近H原子的第1个N原子是sp2杂化的,第二个N原子是sp杂化的,端位的N原子不杂化,故四个原子不在一条直线上,E不正确。综上所述,叙述错误的是DE 。
故答案为:CO2或N2O;DEspan>;
(4)A含有1.5个亚铁离子、4个氯离子,B含有0.5个亚铁离子、4个氧离子、4个铁离
子,则该氧化物中Fe2+、Fe3+、O2-的个数比为1:2:4。
晶胞含有Fe2+、Fe3+、O2-的个数分别是为4、8、16,它们的相对质量之和是8×232,根据m=![]() V可得8×232g= dg/cm3
V可得8×232g= dg/cm3![]() a3
a3![]() NA,a=
NA,a=![]() 107nm;
107nm;
故答案为:1:2:4;![]() 107;
107;
(5)根据均摊原则每个铁原子又为两个八面体共用,所以铁与碳原子数比是6![]() :1=3:1,
:1=3:1,
则该化合物的化学式为Fe3C;
故答案为:Fe3C。

【题目】下表中①~⑦表示元素周期表的部分元素。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
1 | |||||||
2 | ① | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ |
(1)②元素最外层电子数比次外层电子数多______个,该元素的符号是_______;⑦元素的氢化物的电子式为____________________。
(2)由①③④三种元素组成的物质是______________,此物质的水溶液显_____性。
(3)⑥元素的原子半径大于③的理由是____________________________________。
(4)④元素的最高价氧化物对应的水化物的碱性强于⑤元素,用一个化学方程式来证明。________________________________________







