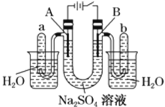
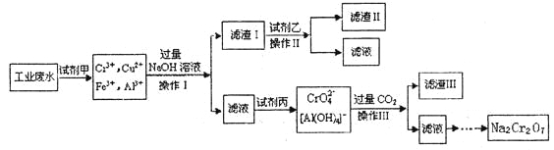
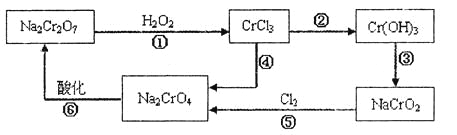
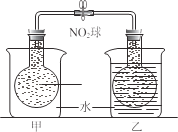
题目内容
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为( )
A.13.2 gB.26.4 gC.19.7 gD.24.4 g
【答案】A
【解析】
CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量。
产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,所以n(H2O)=![]() =1.4mol,根据H原子守恒,可知:n(CH4)=
=1.4mol,根据H原子守恒,可知:n(CH4)=![]() n(H2O)=
n(H2O)=![]() ×1.4mol=0.7mol,根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,且m(CO)+m(CO2)=49.6g-25.2g=24.4g,所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,解之:n(CO2)=0.3mol,所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g,故答案为A。
×1.4mol=0.7mol,根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,且m(CO)+m(CO2)=49.6g-25.2g=24.4g,所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,解之:n(CO2)=0.3mol,所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g,故答案为A。

【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()
【题目】已知反应![]() ,在某温度下的平衡常数为400。此温度下,在密闭容器中加入
,在某温度下的平衡常数为400。此温度下,在密闭容器中加入![]() ,反应进行到某时刻测得各组分的浓度如下:
,反应进行到某时刻测得各组分的浓度如下:
物质 |
|
|
|
浓度 |
|
|
|
下列叙述中正确的是![]()
A.该反应的平衡常数表达式为 ![]()
B.该时刻正、逆反应速率的大小:![]()
C.平衡时![]()
D.若加入![]() 后,经
后,经![]() 反应达到平衡,该时间内反应速率
反应达到平衡,该时间内反应速率![]()