题目内容
1.下列实验装置图完全正确的是( )| A. | 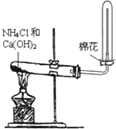 实验室制取并收集氨气 | B. | 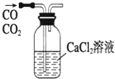 除去CO中混有的CO2 | ||
| C. | 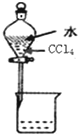 分离水和CCl4的混合物 | D. | 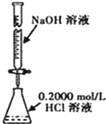 酸碱中和滴定 |
分析 A.加热条件下氯化铵和氢氧化钙反应生成氨气,氨气密度比空气小;
B.二氧化碳不能被氯化钙溶液吸收;
C.水和四氯化碳互不相溶,可分液;
D.氢氧化钠应放在碱式滴定管中.
解答 解:A.实验室可在加热条件下氯化铵和氢氧化钙反应生成氨气,因氨气密度比空气小,可用向下排空法收集,为防止氨气与空气对流,用棉花塞住试管口,故A正确;
B.二氧化碳不能与氯化钙溶液而被吸收,应用氢氧化钠溶液,故B错误;
C.水和四氯化碳互不相溶,可用分液的方法分离,故C正确;
D.氢氧化钠腐蚀玻璃,为防止玻璃塞打不开,应放在碱式滴定管中,故D错误.
故选AC.
点评 本题考查化学实验方案的评价,涉及物质的分离、制备等基本实验,侧重于学生的分析能力、评价能力和实验能力的考查,为高考常见题型,注意把握实验的严密性和相关物质的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.金属钾晶体(如图)的结构的叙述中正确的是( )
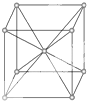

| A. | 是密置层的一种堆积方式 | B. | 晶胞是六棱柱 | ||
| C. | 每个晶胞内含2个原子 | D. | 每个晶胞内含6个原子 |
12.下列离子方程式正确的是( )
| A. | 苯酚钠中通二氧化碳反应:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| B. | 电解饱和食盐水:2H++2Cl?$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | Na2CO3溶液显碱性:CO32-+H2O═HCO3-+OH- | |
| D. | 足量AlCl3溶液与纯碱溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
9.在金属晶体中,根据影响金属键的因素判断下列各组金属熔沸点高低顺序,其中正确的是( )
| A. | Mg>Al>Ca | B. | Al>Na>Li | C. | Al>Mg>Ca | D. | Mg>Ba>Al |
13.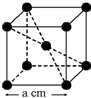 已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
 已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )| A. | NA•a3•ρ | B. | $\frac{{N}_{A}•{a}^{3}•ρ}{6}$ | C. | $\frac{{N}_{A}•{a}^{3}•ρ}{4}$ | D. | $\frac{{N}_{A}•{a}^{3}•ρ}{2}$ |
13.下列关于氧化还原反应中电子转移数目的判断不正确的是( )
| A. | 5.6g铁粉与氯气充分反应失去的电子数一定为0.3NA | |
| B. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeCl2溶液中通入Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题: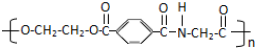 ,则这三种单体的结构简式为CH2OHCH2OH、
,则这三种单体的结构简式为CH2OHCH2OH、 、H2NCH2COOH.
、H2NCH2COOH. 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.