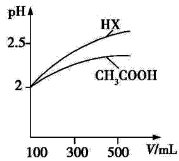题目内容
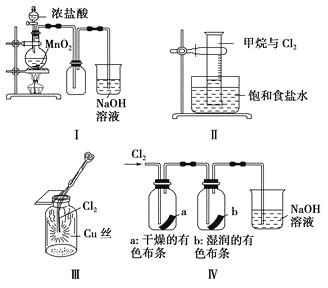
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:
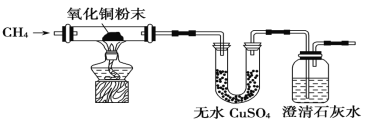
(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ ________ _____ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)已知ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
【答案】I、(1)CH4+4CuO![]() CO2+4Cu+2H2O (2分)
CO2+4Cu+2H2O (2分)
(2)溴单质与甲烷发生了取代反应(1分) ; 用pH试纸检验反应前后溶液的pH,如果pH明显变小,则表明二者发生了取代反应(2分)(或:溴单质被甲烷气体带走 ; 用pH试纸检验反应前后溶液的pH,如果pH没有明显变化,则表明溴单质被甲烷气体带走 )
II、(1)(各1分)反应温度高,能耗大 使用的催化剂毒性大
(2)(各1分)CH2=CH2+Cl2→CH2ClCH2Cl; CH2ClCH2Cl![]() CH2=CHCl+HCl
CH2=CHCl+HCl
【解析】
试题分析:I(1)五水合硫酸铜为蓝色,无水CuSO4逐渐变蓝,说明有水生成,澄清石灰水出现浑浊,说明有二氧化碳生成,根据原子守恒,CH4与CuO反应的化学方程式为:CH4+4CuO![]() CO2+4Cu+2H2O;
CO2+4Cu+2H2O;
(2)CH4通入溴水时,发现溴水逐渐褪色,说明溴参加了反应或溴被带走,因甲烷为饱和烃,所以溴单质可能与甲烷发生了取代反应或溴单质被甲烷气体带走,假如发生取代反应,必有溴化氢产物,用pH试纸检验反应前后溶液的pH,如果pH明显变小,则表明二者可能发生了取代反应,若溴单质被甲烷气体带走,溴单质溶于水显酸性,用pH试纸检验反应前后溶液的pH,如果pH没有明显变化,则表明溴单质可能被甲烷气体带走;
II(2)工业在高温下生产电石,用电石生产乙炔,耗能大,由于乙炔与HCl的反应在氯化汞的作用下进行,使用的催化剂毒性大,污染环境;
(4)以乙烯和氯气为原料制取氯乙烯,可由乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷发生消去反应生成氯乙烯,涉及反应有CH2=CH2+Cl2→CH2ClCH2Cl、CH2ClCH2Cl![]() CH2=CHCl+HCl。
CH2=CHCl+HCl。