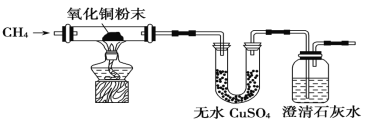
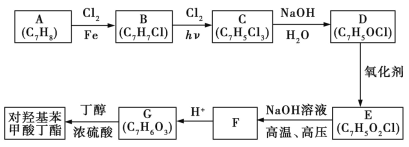
题目内容
【题目】(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。已知某些化学键的键能数据如下表:
化学键 C—C C—H H—H C—O ![]() H—O
H—O
键能/kJ·mol-1 348 413 436 358 1 072 463
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为 。
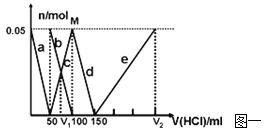
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2 L的密闭容器内充入1 mol CO和2 mol H2,加入合适催化剂(体积可以忽略不计)后在250 ℃开始反应,并用压力计监测容器内压强的变化如下:

则从反应开始到20 min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”)。
(3)下列描述中能说明上述反应已达平衡的是 。
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(Ⅱ)回答下列问题:
(1)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) Ka(CH3COOH)(填“>”、“<”或“=”)。
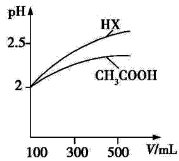
(2)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
【答案】(Ⅰ)(1)CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116 kJ/mol (2)0.012 5 mol/(L·min) 4
CH3OH(g) ΔH=-116 kJ/mol (2)0.012 5 mol/(L·min) 4
减小 (3)BC (Ⅱ)(1)> (2)9.9×10-7
【解析】本题考查了化学反应中的能量变化、化学反应速率与化学平衡、溶液中的平衡等,意在考查考生运用所学知识分析、解决综合问题的能力。(Ⅰ)(1)CO和H2化合来制备甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g),化学反应的过程就是旧化学键断裂和新化学键形成的过程,旧化学键断裂吸收热量,新化学键形成放出热量,该反应的ΔH=1 072 kJ·mol-1+2×436 kJ·mol-1-(3×413 kJ·mol-1+358 kJ·mol-1+463 kJ·mol-1)=-116 kJ·mol-1。
CH3OH(g),化学反应的过程就是旧化学键断裂和新化学键形成的过程,旧化学键断裂吸收热量,新化学键形成放出热量,该反应的ΔH=1 072 kJ·mol-1+2×436 kJ·mol-1-(3×413 kJ·mol-1+358 kJ·mol-1+463 kJ·mol-1)=-116 kJ·mol-1。
(2)设转化的CO为x mol·L-1,

=,解得x=0.25,v(CO)==0.012 5 mol/(L·min),K===4。该反应为放热反应,故升高温度K值减小。(3)当v(H2)正=2v(CH3OH)逆时能说明反应已达平衡,A项错误;容器内气体的总质量为恒量,而容器中气体的总物质的量为“变量”,根据=,可知气体的平均摩尔质量为“变量”,“变量”不变时可说明反应已达平衡,B项正确;容器体积不变,该反应为气体分子数减小的反应,故容器内气体的压强保持不变能说明反应已达平衡,C项正确;D项指的是同一个反应方向,错误。(Ⅱ)(1)稀释时,酸的pH变化越大,酸性越强,其电离常数越大。(2)根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=1.0×10-6 mol·L-1-1.0×10-8 mol·L-1=9.9×10-7 mol·L-1。

【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。